( Магний ) Mg - имеет 12 электронов, 12 протонов и 12 нейтронов;
29:( Медь ) Cu - имеет 29 электронов, 29 протонов и 35 нейтронов;
50:( Олово ) Sn - имеет 50 электронов, 50 протонов и 69 нейтронов;
80:( Ртуть ) Hg - имеет 80 электронов, 80 протонов и 120 нейтронов.
Объяснение:Количество протонов ( p+ ) и электронов ( e- ) в атоме зависит от атомного номера элемента.
Количество нейтронов = атомная масса - протонное число, например: чтобы вычислить количество нейтронов в атоме ртути ( Hg ), нужно его атомную массу ( 200 ) отнять на протонное число ( 80 ):
200 - 80 = 120 нейтронов
1 c.( 1s22s22p4)
2. d (k-)
3. ответ на фотке.
4. а) ἰόν «идущее») — атом или молекула, которая имеет электрический заряд. ... Если ион имеет положительный заряд, он называется катионом, а если отрицательный — анионом.
б) Катион кальция образуется при отдаче ē атомом, приобретая заряд положительный.
5. а) NaCl, CaCl2, AlCl3.
б) FeO , Fe2O3.
6. а) Mr(Fe2O3)=160г/м
w(Fe) = 112/160×100%=70%
w(O) = 48/160×100%=30%
б) Ar(Al) = 27, Ar(O) = 16
Mr(Al2O3) = 27*2 + 16*3 = 102
W(Al) = Ar(Al) *n / Mr(Al2O3) *100% = 27*2 / 102 *100% = 53%
W(O) = Ar(O) *n / Mr(Al2O3) *100% = 16*3 / 102 *100% = 47%
7. 1- в
2-а
3-г
4-б
8. 1. реакция замещения
2. реакция соединения
3. реакция разложения
4. реакция обмена
9. 1 - Б
2 - г
3 - а
4 -в
10. а) Железо не окисляется на сухом воздухе. (1 пробирка)
Если бы во 2 пробирке не было масла, то гвоздь покрылся бы налетом ржавчины ( 2 пробирка)
б)Гвоздь ржавеет, потому что он сделан из железа, которое подвергается коррозии. Железо окисляется кислородом воздуха. (3 пробирка)
Усилению процесса окисления растворы соли. (4 пробирка).
Кислота обладает сильными окислительными свойствами (5 пробирка)
В) В случае с 5 пробиркой.
11.а) Пробирка 1 – Zn
Пробирка 2 - Fe
б) Zn + 2HCl = ZnCl2 + H2
Fe + 2HCl = FeCl2 + H2
12. a). AgNO3 +; HCl+; ZnSO4-; H2O+.
Б) таблицу прикреплю ниже, чтобы понятнее было
Объяснение:
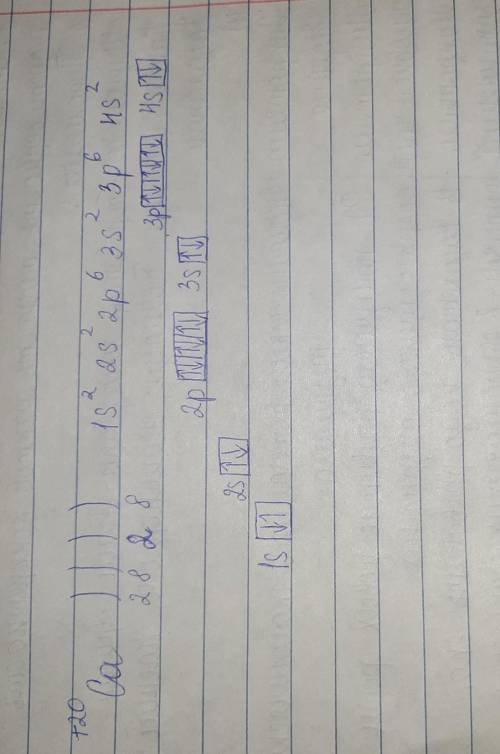
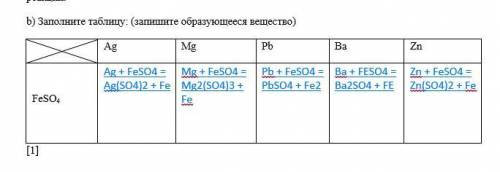
Объяснение:
Напишите уравнения реакций концентрированной и разбавленной азотной кислоты с серебром.
Ag + 2 HNO3(конц) = AgNO3 + NO2↑ + H2O
Ag⁰ - 1e = Ag⁺¹ окисление, Ag⁰ - восстановитель ║1
N⁺⁵ +1e = N⁺⁴ восстановление, HNO3 - окислитель ║1
3 Ag + 4HNO3(разб) = 3AgNO3 + NO + 2H2O
Ag⁰ - 1e = Ag⁺¹ окисление, Ag⁰ - восстановитель ║3
N⁺⁵ +3e = N⁺² восстановление, HNO3 - окислитель ║1