Степень окисления – это вс условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
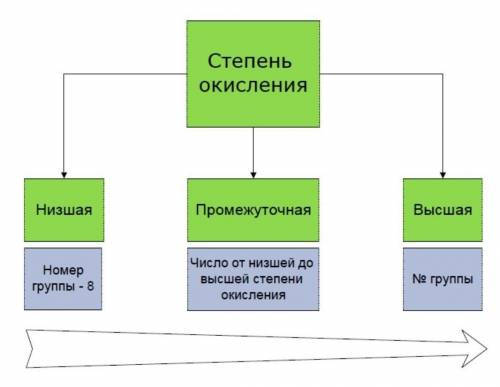
Степени окисления бывают высшие, низшие и промежуточные.
Высшая степень окисления равна номеру группы со знаком «плюс».
Низшая определяется, как номер группы минус 8.
И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.
Например, для азота характерны: высшая степень окисления +5, низшая 5 — 8 = -3, а промежуточные степени окисления от -3 до +5. Например, в гидразине N2 H4 степень окисления азота промежуточная, -2.
Чаще всего степень окисления атомов в сложных веществах обозначается сначала знаком, потом цифрой, например +1, +2, -2 и т.д. Когда речь идет о заряде иона (предположим, что ион реально существует в соединении), то сначала указывают цифру, потом знак. Например: Ca^2+, CO3^2-.
Для нахождения степеней окисления используют следующие правила:
1.Степень окисления атомов в простых веществах равна нулю;
2.В нейтральных молекулах алгебраическая сумма степеней окисления равна нулю, для ионов эта сумма равна заряду иона;
3.Степень окисления щелочных металлов (элементы I группы главной подгруппы) в соединениях равна +1, степень окисления щелочноземельных металлов (элементы II группы главной подгруппы) в соединениях равна +2; степень окисления алюминия в соединениях равна +3;
4.Степень окисления водорода в соединениях с металлами (солеобразные гидриды — NaH, CaH2 и др.) равна -1; в соединениях с неметаллами (летучие водородные соединения) +1;
5.Степень окисления кислорода равна -2. Исключение составляют пероксиды – соединения, содержащие группу –О-О-, где степень окисления кислорода равна -1, и некоторые другие соединения (супероксиды, озониды, фториды кислорода OF2 и др.);
6.Степень окисления фтора во всех сложных веществах равна -1.
Выше перечислены ситуации, когда степень окисления мы считаем постоянной. У всех остальных химических элементов степень окисления — переменная, и зависит от порядка и типа атомов в соединении.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Возможно полезные советы:
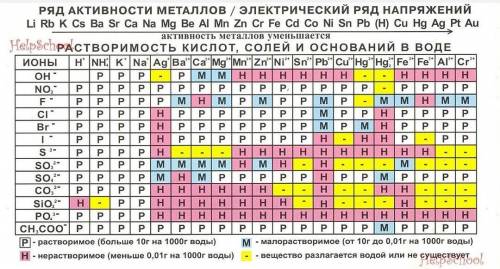
Для упрощения расчетов можно использовать таблицу растворимости – там указаны заряды наиболее распространенных ионов. На большинстве российских экзаменов по химии (ЕГЭ, ГИА, ДВИ) использование таблицы растворимости разрешено. Это готовая шпаргалка, которая во многих случаях позволяет значительно сэкономить время.При расчете степени окисления элементов в сложных веществах сначала указываем степени окисления элементов, которые мы точно знаем (элементы с постоянной степенью окисления), а степень окисления элементов с переменной степенью окисления обозначаем, как х. Сумма всех зарядов всех частиц равна нулю в молекуле или равна заряду иона в ионе. Из этих данных легко составить и решить уравнение.Надеюсь :)
Удачи!
Объяснение:
В скобках - заряды ионов. Подчеркнутое сокращается.
1) CaCl2 + K2CO3 = CaCO3 + 2KCl
Ca(2+) + 2Cl(-) + 2K(+) + CO3(2-) = CaCO3 + 2K(+) + 2Cl (-)
Ca(2+) + CO3(2-) = CaCO3
2) H2SO4 + 2LiOH = Li2SO4 + 2H2O
2H(+) + SO4(2-) + 2Li(+) + 2OH(-) = 2Li(+) + SO4(2-) + 2H2O
H(+) + OH(-) = H2O
3) Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
2Na(+) + CO3(2-) + 2H(+) + 2Cl(-) = 2Na(+) + 2Cl(-) + CO2 + H2O
2H(+) + CO3(2-) = H2O + CO2
4) MgO + 2HCl = MgCl2 + H2O
MgO + 2H(+) + 2Cl(-) = Mg(2+) + 2Cl(-) + H2O
MgO + 2H(+) = Mg(2+) + H2O