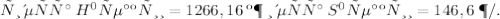
При коррозии во влажном воздухе на поверхности металла образуется пленка из абсорбированных молекул воды и кислорода воздуха. Оцинковка стали является одним из методов электрохимической защиты от коррозии (протекторная защита). Так как цинк легче окисляется (отдает свои электроны кислороду воздуха и воды), а система Zn-Fe-H2O является короткозамкнутой, то пока имеется протектор ( Zn), будет идти преимущественно реакция Zn+1/2O2+H2O=Zn(OH)2. Если отсутствует короткое замыкание через воду и слой абсорбированной воды несплошный (например при конденсации капелек тумана, или при наличии лакокрасочного покрытия), то эффективность защиты снижается. Например на автомобилях с оцинкованным кузовом крупные царапины подвергаются коррозии. Залитые водой оцинкованные поверхности стали (крыши, сливы окон, ведра) не будут активно корродировать, пока имеется хоть небольшое количество цинка.
Другое дело покрытия более благородным металлом, например лужение. Как только сплошность покрытия будет нарушена - начнется коррозия железа (понаблюдайте на поцарапанных банках сгущенки). В этом случае железо по отношению к олову будет выступать протектором, как цинк по отношению к железу.
CH3
|
a)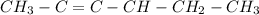
|
CH3
CH3
|
b)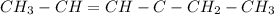
|
CH3
в)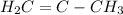
|
CH3
г) CH3
|
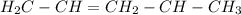
д)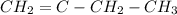
|
CH3
- 1228,3 кДж Отрицательное значение энергии Гиббса указывает, что реакция может самопроизвольно протекать при данных условиях
Объяснение:
При давлении 101,3 кПа и температуре 298,15 К вычислите изменение энергии Гиббса в результате реакции
4NH3 (г) + 3O2 (г) = 2N2 (г) + 6H2O (г)
Может ли эта реакция протекать самопроизвольно при указанных выше условиях?
NH3(4) О2 N2 H2O (г)
ΔH°₂₉₈ кДж/моль - 45,9 0 0 - 241,2
S°₂₉₈ Дж/моль ·K 192,8 205,2 191,6 188,8
ΔH₂₈₈ (реакц) = (- 241,2 ·6) - (-45,9 ·4) = - 1447, + 183,6 =
- 1447,2 + 183,6 = - 1263,6 кДж
ΔS°₂₉₈ (191,6·2 + 188,6· 6) - (192,8·4 + 205,2·3) = 1516,0 - 1386,8 = 129,2 Дж/моль ·К
ΔG = ΔH - T×ΔS = - 1263,6 - 273· 0,1292 = - 1228,3 кДж
Отрицательное значение энергии Гиббса указывает, что реакция может самопроизвольно протекать при данных условиях