5 г х г
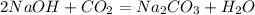
80 г 106 г
1. Сначала найдем чистую массу гидроксида в растворе(просто умножив массу раствора на массовую долю гидроксида в нем):
m(NaOH)=m(раствора)*w(NaOH)=20*0,25=5 г
2. Подставив эту массу в уравнение реакции,и получим массу соли(карбоната натрия):
при взаимодействии 80 г гидроксида получается 106 г карбоната, а
при --//--//-- 5 г_____________________х г, откуда
х=106*5/80=6,625 г
ответ: 15 л
Объяснение:
т.к медь не реагирует с HCL, то
mg+2hcl=mgcl2+h2
т.к меди 20%, то магния 80%
m(mg)=20*(80/100)=16 г
n(mg)=m/M=16/24=0.67 моль
n(h2)=n(mg)=0.67
V(h2)=n*Vm=0.67*22.4=15 л