Відповідь:
w(H₂SO₃)=3.59%
Пояснення:
Дано: m(Cu)=3.2 g ; m(раствора H₂SO₄)=80 g , w(H₂SO₄)=98% ; wвихода(SO₂)=90% m(растворителя)=100 g
a) I. Запишем реакцию:
Cu + 2 H₂SO₄ → 2 H₂O + SO₂ ↑+ CuSO₄
С реакции видно, что соотношение количества между реагентами, как 1:2.
То есть, n(Cu) должно быть равно с 2n(H₂SO₄)
II. Запишем формулы // Проведем вычисления:
n(E)=m(E)/Mr(E)
w(E)=m(E)/m(раствора) · 100%
wвыхода(E)=mпр/mтеор · 100%
m(E)=w(E)*m(розчину) / 100%
m(H₂SO₄)=80*98/100=78.4 g
n(Cu)=3.2/64=0.05 моль
n(H₂SO₄)=78.4/98=0.8 моль
Значит, медь в нехватке, поэтому расчет ведем за ней.
n(Cu)=n(SO₂)=0.05 моль
mтеор(SO₂)=0.05*64=3.2 g
mпр(SO₂)=90*3,2/100=2.88 g
б) I. Запишем реакцию:
SO₂ +H₂O → H₂SO₃
С реакции видно, что соотношение количества между SO₂ i H₂SO₃ , как 1:1 . То есть, n(SO₂) должно быть равно с n(H₂SO₃).
II. Сделаем соотношение за количеством реагента и продукта:
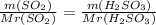
m(H₂SO₃)=2.88*82/64=3.69 g
Таким же соотношением находим массу воды:
m(H₂O)=3.69*18/82=0,81 g - столько воды "впитал" в себя газ
m(растворителя)=100-0,81=99.19 г
III. Вспоминаем правило химика: "То, что попало в колбу, безследно никуда не пропадает" - тоесть, масса раствора = масса растворителя (воды) + масса кислоты
w(H₂SO₃)=3.69*100% / 99.19+3.69
w(H₂SO₃)=369/102.88=3.59%
*Поставьте лучшее
О прикольно вы в 8 классе учитесь
Вот держи :
1. Составим уравнение реакции сульфата меди с гидроксидом калия:
CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4;
2. рассчитаем массу сульфата меди:
m (CuSO4) = w (CuSO4) * m (раствора) = 0,2 * 980 = 196 г;
3. найдем химическое количество сульфата меди:
n (CuSO4) = m (CuSO4) : M (CuSO4);
M (CuSO4) = 64 + 32 + 4 * 16 = 160 г/моль;
n (CuSO4) = 196 : 160 = 1,225 моль;
4. по уравнению реакции один моль сульфата меди соответствует 1 моль образующегося гидроксида меди:
n (Cu(OH)2) = n (CuSO4) = 1,225 моль;
5. вычислим массу осадка:
m (Cu(OH)2) = n (Cu(OH)2) * M (Cu(OH)2);
M (Cu(OH)2) = 64 + 2 * 17 = 98 г/моль;
m (Cu(OH)2) = 1,225 * 98 = 120,05 г.
ответ: 120,05 г.5. вычислим массу осадка:
m (Cu(OH)2) = n (Cu(OH)2) * M (Cu(OH)2);
M (Cu(OH)2) = 64 + 2 * 17 = 98 г/моль;
m (Cu(OH)2) = 1,225 * 98 = 120,05 г.
ответ: 120,05 г.