ω%(H)=17,24%
D(H₂)=29
Определить молекулярную формулу-?
1.ω%(C)=100% -17,24%=82,76%
2. Определим молярную массу вещества:
M(в-ва)=D(H₂)×M(H₂)
M(в-ва)=29 ×2г./моль=58г./моль
3.Находим истинную молярную массу:
m(C) = 58 x 0,8421 =48
m(H)=58x0,1724=10
4. Находим массы атомов углерода и водорода в этом веществе по их массовым долям:
число атомов С 48÷12 = 4
число атомов(H) = 10÷1 = 10
5. Формула — С₄Н₁₀
6. Проверим молярную массу бутана:
M(С₄Н₁₀)=12x4+10=48+10=50
7. ответ молекулярная формула вещества С₄Н₁₀
Дано:
m р-р(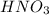 ) = 15 г
) = 15 г
ω(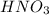 ) = 20%
) = 20%
m(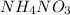 ) — ?
) — ?
Реакция нейтрализации азотной кислоты раствором аммиака —
Найдём массу азотной кислоты в растворе:
m(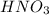 ) = m р-р(
) = m р-р(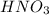 ) * ω(
) * ω(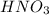 ) = 15 г * 0,2 = 3 г.
) = 15 г * 0,2 = 3 г.
Исходя из полученного результата, выйдем на количество азотной кислоты:
n(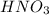 ) = m(
) = m(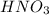 ) / M(
) / M(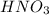 ) = 3 г / 63 г/моль ≈ 0,0476 моль
) = 3 г / 63 г/моль ≈ 0,0476 моль
Так как по уравнению индексы при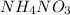 и
и 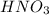 совпадают, то их количество равно:
совпадают, то их количество равно:
n(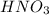 ) = n(
) = n(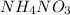 ), следовательно
), следовательно
n(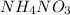 ) = 0,0476 моль.
) = 0,0476 моль.
Тогда масса нитрата аммония равна
m(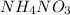 ) = n(
) = n(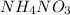 ) * M(
) * M(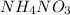 ) = 0,0476 моль * 80 г/моль ≈ 3,8 г
) = 0,0476 моль * 80 г/моль ≈ 3,8 г
ответ: m(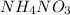 ) = 3,8 г.
) = 3,8 г.