Уравнение реакции: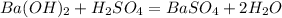
Необходимо найти количество вещества серной кислоты и сравнить его с количеством вещества гидроксида бария:
Масса серной кислоты : 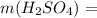 98*0,383 = 37,534 г.
98*0,383 = 37,534 г.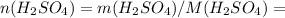 37,534 / 98 = 0,383 моль
37,534 / 98 = 0,383 моль
По уравнению реакции, 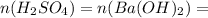 0,383 моль
0,383 моль
Теперь можно найти массу гидроксида бария: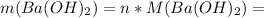 = 0,383 * 171 = 65,493 г.
= 0,383 * 171 = 65,493 г.
ответ: 65,494 г.
1)Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
2Na(+) + CO3(-2) + 2H(+) + 2NO3(-) = 2Na(+) + 2NO3(-) + CO2 + H2O
CO3(-2) + 2H(+) = CO2 + H2O (реакция возможна)
2) СuCl2 + 2NaNO3 = Cu(NO3)2 + 2NaCl
Cu(+2) +2Cl(-) + 2Na(+) + 2NO3(-) = Cu(+2) + 2NO3(-) + 2Na(+) + 2Cl(-)
( реакция невозможна)
3) KCl + NaNO3 = KNO3 + NaCl
K(+) + Cl(-) + Na(+) + NO3(-) = K(+) + NO3(-) + Na(+) + Cl(-)
(реакция невозможна)
4) Ca(OH)2 +2 KNO3 =Ca(NO3)2 + 2KOH
Ca(OH)2 + 2K(+) + 2NO3(-) = Ca(+2) + 2NO3(-) + 2K(+) + 2OH(-)
Ca(OH)2 = Ca(+2) + 2OH(-)
(реакция возможна)
Дано
ω (Н2SO4) = 38,3%
m(р-ра Н2SO4) = 98гр
Найти:
m(Ва(ОН)2) - ?
m = 38 гр Хгр
Н2SO4 + Ва(OH)2 = ВaSO4 + 2H2O
m=98гр m=171гр
ω = m(в-ва) х 100% / m( р-ра)
m(в-ва) = ω х m( р-ра) / 100%
m(H2SO4) = 38,3% x 98гр /100% = 38гр
Находим массу гидроксида бария, составляем пропорцию
38гр / 98гр = Хгр / 171гр
m(Ва(ОН)2) = 38гр х 171гр / 98гр = 66,3 гр