1. Напишем реакции в общем виде.
CnH2n-2 + 2H₂ = CnH2n+2.
CnH2n+2 + Cl₂ = CnH2n-1Cl + HCl.
2. По уравнениям реакций мы видим, что количество вещества (моль) CnH2n-2 равно количеству вещества CnH2n-1Cl, значит мы можем сделать пропорцию.
m (CnH2n-2) ÷ M (CnH2n-2) = m (CnH2n-1Cl) ÷ M (CnH2n-1Cl). Подставим все значения в эту пропорцию и сделаем уравнение.
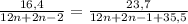
3. Переносим это всё в левую сторону, подводим две дроби к общему знаменателю, домножаем числители, приравниваем всё это дело к нулю.
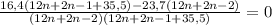
4. Знаменатель можно откинуть, с ним мы не работаем. Написала для наглядности, чтобы было понятно, как я решала. Далее решаем по правилу: дробь равна нулю, когда числитель равен нулю.
16,4(12n+2n-1+35,5)-23,7(12n+2n-2) = 0
Не буду расписывать всё решение, потому что это химия, а не алгебра.
В общем, в итоге у нас получается n = 6.
Таким образом, формула исходного углеводорода — C₆H₁₀, атомов водорода в нём = 10.
ответ: 10.
Zn + H₂SO₄ = ZnSO₄ + H₂
n=65моль n=1моль n=1моль
M=65г/моль M=98г/мол Vm=22,4л/моль
m=65г m=98 г V=22,4л
1)сначала найдем недостаток или избыток.
13/65=0,2
20/98=0,204
расчет ведем по цинку,он взят в недостатке
13гхл
65г22,4л
х=(22,4л*13г)/65г=4,48л
или можно решить так:
2)n(Zn)=13г/65г/моль=0,2моль
n(Zn)=n(H₂SO₄)=n(H₂)=0,2моль
V(H₂)=0,2моль*22,4л/моль=4,48л
ответ:4,48л