.Получение метана Метан в лаборатории получают прокаливанием безводного ацетата натрия с натронной известью. Натронная известь представляет собой смесь гидроксида натрия с гидроксидом кальция.
Оборудование Натронная известь, ацетат натрия, пробирка с газоотводной трубкой, горелка, лучина
Техника безопасности Опыт требует осторожного обращения с огнем. Проверка метана на чистоту аналогична проверке водорода на чистоту.
Образовательный уровень базовый курс, самообразование
Источники Постановка опыта и текст - к.п.н. Павел Беспалов
Описание опыта
Смешаем натронную известь с ацетатом натрия, тщательно перемешаем и поместим в пробирку. Закроем пробирку пробкой с газоотводной трубкой. Нагреем смесь. Через некоторое время начинает выделяться метан
CH3COONa + NaOH = CH4 + Na2CO3
Поджигаем метан. Он горит почти бесцветным пламенем. При горении метана образуется углекислый газ и вода.
Кремний находятся в периодической системе в 4 группе главной подгруппе. Его порядковый номер 14, относительная атомная масса кремния Ar(Si)=26 Заряд ядра кремния равен +14. В ядре находятся 14 протонов и 12 нейтронов, вокруг ядра на 3 энергетических уровнях находятся 14 электронов. ₊₁₄Si Z=+14 р⁺=14 n⁰=12 е⁻=14 Электронная формула кремния: ₊₁₄Si 1s²2s²2p⁶3s²3p² На последнем уровне у кремния 4 электрона. Исходя из этого кремний может проявлять себя, как восстановитель, и как окислитель: Si⁰-4e⁻ ⇒Si⁺⁴ восстановитель Si⁺⁴O₂⁻² Si⁰+4e ⇒ Si⁻⁴ окислитель Si⁻⁴H₄⁺
Атомный радиус у кремния больше чем у углерода, отсюда металлические свойства сильнее проявляются у кремния(кремний поупроводник) чем у углерода.
Диссоциация азотной кислоты:
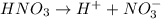
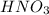 = концентрации
= концентрации  = 0,4 М
= 0,4 М
![pH = -lg [ H^+]](/tpl/images/0140/7871/c93c5.png) = -lg[0,4] = 0,4
= -lg[0,4] = 0,4
Сильная кислота, диссоциирует полностью, значит концентрация
pH расчитывается по формуле:
ответ: 0,4