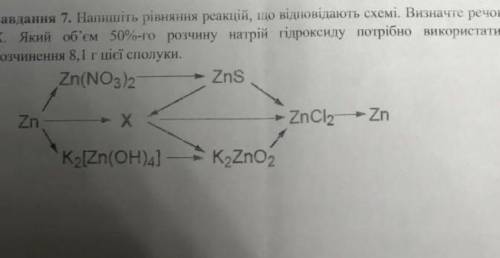
Объяснение:
Уравнивание методом электронного баланса окислительно – восстановительных реакций.
Закончить уравнения реакций и расставить коэффициенты методом электронного баланса
1) Zn + H2SO4(p) = ZnSO4 + H2↑
Zn(0) - 2e = Zn(+2) окисление, Zn - восстановитель║1
2H(+) + 2e = H2(0) восстановление, 2H(+) - окислитель║1
2) S +Zn = ZnS
S(0) +2e = S(-2) восстановление, 2H(+) - окислитель║1
Zn(0) - 2e = Zn(+2) окисление, Zn - восстановитель║1
3) S + H2 →
S(0) +2e = S(-2) восстановление, 2H(+) - окислитель║1
H2(0) - 2e = 2H+ окисление, H2 - восстановитель║1
4) 2Na + 2H2O = 2NaOH + H2↑
Na(0) - 1e = Na+ окисление, Na - восстановитель║2
2Н(+) + 2е = Н2(0) восстановление 2Н(+) - окислитель║1
5) 2Na + Cl2 = 2NaCl
Na(0) - 1e = Na+ окисление, Na - восстановитель║2
Cl2(0) +2e = 2Cl(-) восстановление, Cl2 - окислитель║1
6)6Li + N2 = 6LiN2
N2 + 6e = 2N(-3) восстановление, N2 - окислитель║1
Li(0) - 1e = Li(+1) окисление, Li(0) - восстановитель ║ 6
7) N2 + Mg = Mg3N3
N2 + 6e = 2N(-3) восстановление, N2 - окислитель║1
Mg(0) - 2e = Mg(+2) окисление, Mg- восстановитель║1
8) 4Al + 3O2 = 2Al2O3
Al(0) - 3e = Al(+3)окисление, Al- восстановитель║ 4
O2(0) + 4e = 2O(-2) восстановление О2 - окислитель║3
9) 3Cu + 8HNO3(p) → 3Cu(NO3)2 + 2NO + 4H2O
Cu(0) - 2е = Cu(+2) окисление, Cu восстановитель║3
N(+5) +3e =N(+2) восстановление HNO3 окислитель ║2
10) 4Ca +10 HNO3(p) = 4 Ca(NO3)2 + NH4NO3 + 3H2O
Са(0) +2е = Са(+2) окисление, Са восстановитель ║4
N(+5) +8 = N(-3) восстановление НNO3 -окислитель ║1
11) 4NH3 +5 O2 → 4NO + 6H2O
N(-3) -5e = N(+2) окисление NH3 - восстановитель ║ 4
О2(0) +4е = 2О(-2) восстановление О2 - окислитель║5
12) 4NH3 + 3O2 →2 N2 + 6H2O
N(-3) -6e = N2(0) окисление NH3 - восстановитель ║ 2
О2(0) +4е = 2О(-2) восстановление О2 - окислитель║3
Объяснение:
Объяснение:
Уравнивание методом электронного баланса окислительно – восстановительных реакций.
Закончить уравнения реакций и расставить коэффициенты методом электронного баланса
1) Zn + H2SO4(p) = ZnSO4 + H2↑
Zn(0) - 2e = Zn(+2) окисление, Zn - восстановитель║1
2H(+) + 2e = H2(0) восстановление, 2H(+) - окислитель║1
2) S +Zn = ZnS
S(0) +2e = S(-2) восстановление, 2H(+) - окислитель║1
Zn(0) - 2e = Zn(+2) окисление, Zn - восстановитель║1
3) S + H2 →
S(0) +2e = S(-2) восстановление, 2H(+) - окислитель║1
H2(0) - 2e = 2H+ окисление, H2 - восстановитель║1
4) 2Na + 2H2O = 2NaOH + H2↑
Na(0) - 1e = Na+ окисление, Na - восстановитель║2
2Н(+) + 2е = Н2(0) восстановление 2Н(+) - окислитель║1
5) 2Na + Cl2 = 2NaCl
Na(0) - 1e = Na+ окисление, Na - восстановитель║2
Cl2(0) +2e = 2Cl(-) восстановление, Cl2 - окислитель║1
6)6Li + N2 = 6LiN2
N2 + 6e = 2N(-3) восстановление, N2 - окислитель║1
Li(0) - 1e = Li(+1) окисление, Li(0) - восстановитель ║ 6
7) N2 + Mg = Mg3N3
N2 + 6e = 2N(-3) восстановление, N2 - окислитель║1
Mg(0) - 2e = Mg(+2) окисление, Mg- восстановитель║1
8) 4Al + 3O2 = 2Al2O3
Al(0) - 3e = Al(+3)окисление, Al- восстановитель║ 4
O2(0) + 4e = 2O(-2) восстановление О2 - окислитель║3
9) 3Cu + 8HNO3(p) → 3Cu(NO3)2 + 2NO + 4H2O
Cu(0) - 2е = Cu(+2) окисление, Cu восстановитель║3
N(+5) +3e =N(+2) восстановление HNO3 окислитель ║2
10) 4Ca +10 HNO3(p) = 4 Ca(NO3)2 + NH4NO3 + 3H2O
Са(0) +2е = Са(+2) окисление, Са восстановитель ║4
N(+5) +8 = N(-3) восстановление НNO3 -окислитель ║1
11) 4NH3 +5 O2 → 4NO + 6H2O
N(-3) -5e = N(+2) окисление NH3 - восстановитель ║ 4
О2(0) +4е = 2О(-2) восстановление О2 - окислитель║5
12) 4NH3 + 3O2 →2 N2 + 6H2O
N(-3) -6e = N2(0) окисление NH3 - восстановитель ║ 2
О2(0) +4е = 2О(-2) восстановление О2 - окислитель║3
Объяснение: