Объяснение:
Х г 0,1 моль
1) CuO + H2 -> Cu + H2O
n = 1 моль n=1 моль
М = 64 г/моль
m=64 г
Х г CuO - 0,1 моль Cu
64 г CuO - 1 моль Cu
m(CuO) = 64 * 0,1 / 1 = 6,4 г
40 г Х л
2) CaCO3 -> CaO + CO2
n=1 моль n=1 моль
М = 100 г/моль Vm=22,4 л/моль
m=100 г V = 22,4 л
40 г СаСО3 - Х л СО2
100 г СаСО3 - 22,4 л СО2
V(CO2) = 40 * 22,4 / 100 = 8,96 л
16.9%
Объяснение:
Пишем первую реакцию
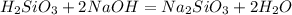
Считаем массу гидроксида натрия
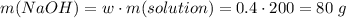
Считаем количество вещества кремниевой кислоты
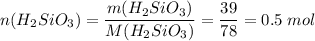
Для реакции нужно вдвое больше гидроксида натрия, т.е. 1 моль или 40 г, а есть 80 г, поэтому расчеты ведем по кремниевой кислоте
Силиката натрия образуется столько же, сколько и было кремниевой кислоты, т.е. 0.5 моль
Пишем вторую реакцию
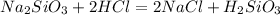
Для полного взаимодействия с 0.5 моль силиката натрия нужно 1 моль кислоты, т.е. 36.5 г. Считаем сколько есть
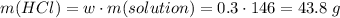
Видим, что соляной кислоты в избытке, поэтому расчеты ведем по силикату натрию
Во время реакции образуется 1 моль хлорида натрия, т.е. 58.5 г и 0.5 моль кремниевой кислоты, т.е. 39 г, которая выпадает в осадок и в массе раствора не считается
Считаем всю массу раствора
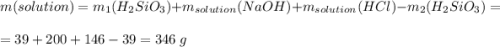
Считаем массовую долю хлорида натрия

1. 2C2H5OH+2Na->2C2H5ONa+H2. n(C2H5OH)=m/M=4,6/46=0,1моль=n(Na), m(Na)=n*M=0,1*23=2,3г. ответ: m(Na)=2,3г.
2. CH2-OH CH2-OK n(глицерина)=m/M=46/92=0,5моль=2/3n(H2),
2CH-OH + 6K-> 2CH-OK + 3H2, n(H2)=0,5*3/2=0,75моль, V(H2)=n*Vмоль=0,75*
CH2OH CH2-OK 22,4=16,8л. ответ: V(H2)=16,8л.
3. CH4+3O2->CO2+2H2O. V(O2)=3V(CH4)(по закону объёмных отношений газов)=60кубических метров. ответ: V(O2)=60м в кубе.
4. C2H2+H2O->CH3-CHO. n(C2H2)=m/M=52/26=2моль=n(CH3-CHO), m(CH3-COH)=n*M=2*44=88г. ответ: m(CH3-CHO)=88г.
5. CH3CHO+Ag2O->2Ag+CH3COOH. n(CH3CHO)=m/M=22/44=0,5моль=0,5n(Ag), n(Ag)=0,5*2=1моль, m(Ag)=n*M=1*108=108г. ответ: m(Ag)=108г.
6. 2CH3COOH+Mg->(CH3COO)2Mg+H2. n(Mg)=m/M=2,4/24=0,1моль=n(H2), V(H2)=n*Vмоль=0,1*22,4=2,24л. ответ: V(H2)=2,24л.