Объяснение:
Дано:
m(NH2-CH2-COOH р-р) = 75 г.
w(NH2-CH2-COOH) = 6%
m(NaOH р-р) = 50 г.
w(NaOH) = 6%
Найти:
Массовые доли веществ в растворе
NH2-CH2-COOH + NaOH = NH2-CH2-COONa + H2O
m(р-ра общ.) = m(NH2-CH2-COOH р.р) + m(NaOH р-р) = 75 + 50 = 125 г.
m(NH2-CH2-COOH) = m(р-ра) * w(р.в) = 75 * 0,06 = 4,5 г.
n(NH2CH2COOH) = m / M = 4,5 / 75 = 0,06 моль
M(NH2CH2COOH) = 75 г/моль
m(NaOH) = m(р-ра) * w(р.в) = 50 * 0,06 = 3 г.
n(NaOH) = m / M = 3 / 40 = 0,075 моль - В избытке
M(NaOH) = 40 г/моль
n(NaOH) > n(NH2CH2COOH) - глицин в недостатке, значит все расчеты ведем по нему.
n(NH2CH2COOH) : n(NH2CH2COONa) = 1 : 1 ;
n(NH2CH2COONa) = 0,06 моль
m(NH2CH2COONa) = n * M = 0,06 * 97 = 5,82 г.
w(NH2CH2COONa) = m(р.в) / m(р-ра) = 5,82 / 125 = 0,05 = 5%
Поскольку щелочь была в избытке, а отношение реактивов 1 к 1, то она осталась в растворе.
n(NH2CH2COONa) : n(NaOH) = 1 : 1 ; n(NaOH вступ.) = 0,06 моль
n(NaOH ост.) = n(NaOH) - n(NaOH вступ.) = 0,075 - 0,06 = 0,015 моль
m(NaOH вступ.) = n * M = 0,015 * 40 = 0,6 г.
w(NaOH) = m(р.в) / m(р-ра) = 0,6 / 125 = 0,005 = 0,5%
ответ: 1) w(NH2CH2COONa) = 5% ; 2) w(NaOH) = 0,5%
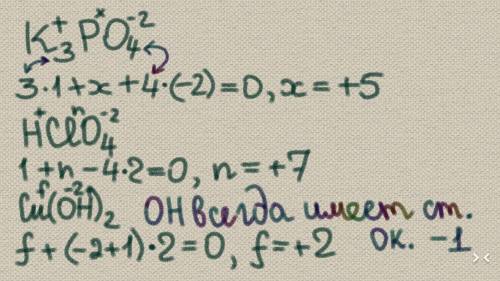
Объяснение:
1) 2K(+)Cl(+5)O3(-2) -> 2 K(+)Cl(-) + 3O2(0) - Q (kat)
Cl(+5) +6e = Cl(-) 2 ок-ль, в-ие
O(-2) -2e = O(0) 6 в-ль, ок-ие
ОВР, необратимая, эндотермическая, разложение, каталитическая.
2) N2(0) + O2 (0)= 2N(+2)O(-2) -Q
N2(0)-4e = 2N(+2) 1 в-ль, ок-ие
O2(0) +4e = 2O(-2) 1 ок-ль, в-ие
ОВР, обратимая, эндотермическая, соединение, некаталитическая
3)Cu(NO3)2 + 2KOH = Cu(OH)2 + 2KNO3
Cu(+2)N(+5)O(-2) + 2K(+)O(-2)H(+) =Cu(+2)O(-2)H(+) + 2K(+)N(+5)O(-2)
Реакция ионного обмена, некаталитическая, необратимая
4) Fe(0) + H2(+)S(+6)O4 (-2)= Fe(+2)S(+6)O4(-2) + H2(0) + Q
Fe(0)-2e = Fe(+2) 1 в-ль, ок-ие
2H(+) +2e = H2(0) 1 ок-ль, в-ие
ОВР, замещения, необратимая, некаталитическая.