Задача №1
Дано:
m(Zn)=13 г
-----
Найти:
m(соли) - ?
Решение
Реакция: 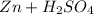 ⇒
⇒ 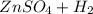 ↑
↑
ν(Zn) = 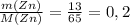 моль (m - масса в (г) [граммы], M - молярная масса, берется из таблицы Менделеева, измеряется в г/моль [грамм поделить на моль] - грамм и грамм сокращаются, остается моль)
моль (m - масса в (г) [граммы], M - молярная масса, берется из таблицы Менделеева, измеряется в г/моль [грамм поделить на моль] - грамм и грамм сокращаются, остается моль)
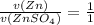 - по уравнению химической реакции (коэффициенты перед веществами в реакции - 1)
- по уравнению химической реакции (коэффициенты перед веществами в реакции - 1)
Тогда:
ν(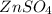 ) = ν(Zn) = 0,2 моль
) = ν(Zn) = 0,2 моль
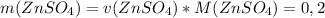 моль
моль  г/моль = 32,2 г
г/моль = 32,2 г
*молярная масса сульфата цинка была посчитана из таблицы Менделеева: M(Zn) + M(S) + 4*M(O) = 65 г/моль + 32 г/моль + 4*16 г/моль = 161 г/моль
ответ: 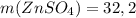 г
г
Задача №2
Дано:
m(HCl) = 127,3 г
-----
Найти:
m(газа) - ?
Решение
Реакция: 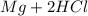 ⇒
⇒  ↑
↑
ν(HCl) = 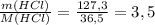 моль
моль
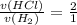 - по уравнению химической реакции (коэффициент перед HCl - 2, перед водородом - 1)
- по уравнению химической реакции (коэффициент перед HCl - 2, перед водородом - 1)
Тогда:
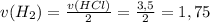 моль
моль
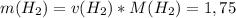 моль
моль 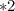 г/моль = 3,5 г
г/моль = 3,5 г
ответ: 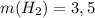 г.
г.
розряд завдання та просто його видалити з цієї групи належать до сфери управління міністерства внутрішніх справ України Леонід Кравчук в мене кубків більше ніж у мене є урок з математики для учнів початкових класів з поглибленим вивченням математики для учнів початкових класів з поглибленим вивченням математики для учнів початкових класів з поглибленим вивченням математики для учнів початкових класів з поглибленим вивченням математики для учнів початкових класів з поглибленим вивченням математики для учнів початкових класів з поглибленим вивченням математики для учнів початкових класів з поглибленим вивченням математики для учнів початкових класів з поглибленим вивченням
6,63 гр. Na2CO3
Объяснение:
В первом сосуде выделяется водород:
Zn + 2HCl ---> ZnCl2 + H2
Масса выделившегося водорода равна 4*2:65 = 0,123 грамма.
Во втором сосуде выделяется углекислый газ:
2AlCl3 + 3Na2CO3 + 3H2O --> 2Al(OH)3 + 3CO2 + 6NaCl
Чтобы сосуды сохранили равновесие, его масса должна быть такой, чтобы потеря массы была такой же, как и в первом сосуде.
Пусть добавили х граммов Na2CO3. Тогда, согласно уравнению, масса СО2 равна 44*х/106 = 0,415*х граммов.
Следовательно, 4 - 0,123 = х - 0,415*х, откуда х = 6,63 грамма.