
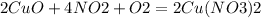

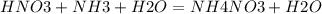
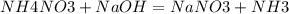

2. опять же находим исходные компоненты
в исходном растворе 214*2%/100%=4,28г веществаи 209,72г воды
если внесли 13г соли то вещества стало17,28
если внесли 13г воды, то растворителя стало 222,72 г
масса конечного раствора 222,72+17,28=240г
доля соли 17,28/240=0,072 или 7,2%
3. в 812г 7% раствора : 56,84г соли и 755,16г воды
после добавления соли: масса соли 60, 84г, воды 755,16г а раствора 816
массовая доля вещества в конечном растворе 60,84/840=0,075 (7,5%)
4. 13г/215г = 0,06 (6%)
5. 4/318 = 0,013 (1,3%) доля вещества
масса воды 318-4=314г