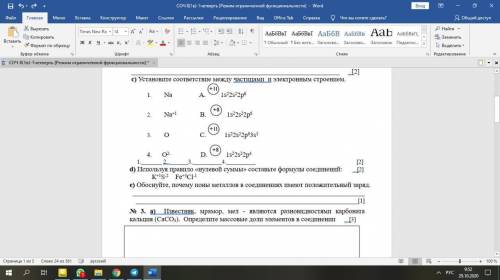
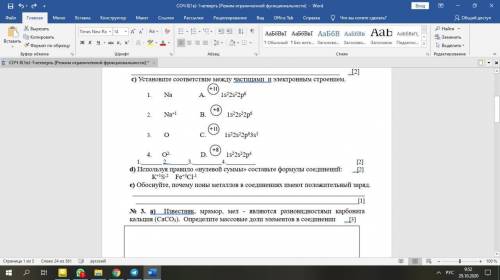
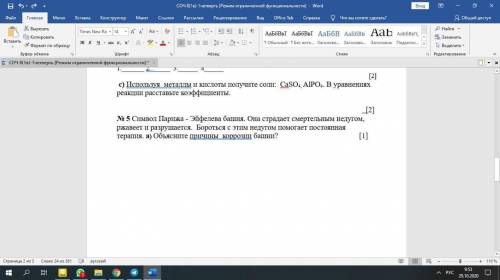
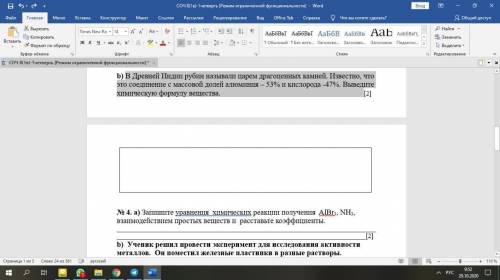
Первым элементом с таким нарушением является хром. Рассмотрим подробнее его электронное строение (рис. 6.16 а). У атома хрома на 4s-подуровне не два, как этого следовало бы ожидать, а только один электрон. Зато на 3d-подуровне пять электронов, а ведь этот подуровень заполняется после 4s-подуровня (см. рис. 6.4). Чтобы понять, почему так происходит, посмотрим, что собой представляют электронные облака 3d-подуровня этого атома.
Каждое из пяти 3d-облаков в этом случае образовано одним электроном. Как вы уже знаете из § 4 этой главы, общее электронное облако таких пяти электронов имеет шарообразную форму, или, как говорят, сферически симметрично. По характеру распределения электронной плотности по разным направлениям оно похоже на 1s-ЭО. Энергия подуровня, электроны которого образуют такое облако, оказывается меньше, чем в случае менее симметричного облака. В данном случае энергия орбиталей 3d-подуровня равна энергии 4s-орбитали. При нарушении симметрии, например, при появлении шестого электрона, энергия орбиталей 3d-подуровня вновь становится больше, чем энергия 4s-орбитали. Поэтому у атома марганца опять появляется второй электрон на 4s-АО.
Сферической симметрией обладает общее облако любого подуровня, заполненного электронами как наполовину, так и полностью. Уменьшение энергии в этих случаях носит общий характер и не зависит от того, наполовину или полностью заполнен электронами какой-либо подуровень. А раз так, то следующее нарушение мы должны искать у атома, в электронную оболочку которого последним "приходит"девятый d-электрон. И действительно, у атома меди на 3d-подуровне 10 электронов, а на 4s-подуровне только один
Опыт: проведение реакций, характеризующих свойства нерастворимых оснований на примере гидроксида меди (II)
Гидроксид меди (II) можно получить, добавив щелочь к раствору соли меди (II):
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
(щелочь должна быть в избытке)
1) Рагируют с кислотами с образованием соли и воды. Делим полученный осадок на две порции и приливаем к первой порции соляную кислоту (небольшими порциями, при перемешивании) до растворения осадка:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
(полученная соль — хлорид меди (II))
2) Нерастворимые гидроксиды разлагаются при нагревании, образуется оксид металла и вода. Вторую порцию осадка нагреваем на спиртовке несколько минут, не доводя до бурного кипения:
Cu(OH)2 = CuO + H2O
Синий осадок меняет цвет на черный, характерный для оксида меди (II).
3) Нерастворимые основания не изменяют окраску индикаторов.
Данный опыт проводить вряд ли понадобится, но нужно помнить, что для него нужен готовый (фабричный) гидроксид меди. Если получать в классе, в нем будет избыток щелочи или сохранится кислая реакция в результате гидролиза хлорида меди (II).