Запишем сначала уравнение: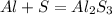
Коэффициенты в этом уравнении будут напрямую зависеть от электронов и степеней окисления атомов элментов, давайте разберем переходы электронов и изменения степеней окисления:
Рассмотрим алюминий:
алюминий был 0 стал +3, форма записи: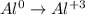
среа, была 0, стала -2: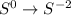
Теперь, чтоюы составить полуреаакции окисления и восстановления, нам надо разобраться с электронами:
чтобы алюминий из 0 стал +3, ему надо отдать три электрона(процесс окисление)
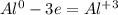
чтобы сера из 0 превратилась в -2, ей надо принять 2 электрона: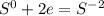
Суммируем эти два уравнения: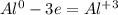
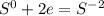
Теперь, нам надо, чтобы число отданных электронов равнялось числу принятых, для этого надо найти общее кратное у принятых и отданных электронов, у 3 и 2 - это 6, теперь, чтоюы у алюминия было 6, надо домножить на 2, а у серы надо домножить на 3, получим на выходе:
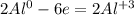 - окисление - восстановитель
- окисление - восстановитель
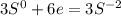 - восстановление - окислитель
- восстановление - окислитель
И записываем уравнение в молекулярном виде:
щелочь взаимодействует и с фенолом и с кислотой
с бромной водой взаимодействует только фенол
33.1г
С6H5OH + 3Br2 = C6H2Br3OH + 3HBr
кол-во осадка = 33,1/331=0,1моль
т.к. отношения осадка и фенола в УХР одномолярные, то и фенола прореагирует 0,1 моль
масса фенола = 0,1*94=9,4г
массовая доля фенола = 9,4/200=0,047 или 4,7%
масса растовра щелочи = 91*1,109=100,92г
масса щелочи = 0,1*100,92=10,09г
кол-во щелочи = 10,09/40=0,25моль
с фенолом ее прореагирует 0,1 моль т.к отношения по УХР одномолярные
С6Н5ОН + NaOH = C6H5ONa + H2O
значит на реакцию с кислотой пойдет 0,15 моль щелочи
NaOH = CH3COOH = CH3COONa + H2O
отношения однмолоярные, значит кол-во кислоты = колву щелочи = 0,15 моль
масса кислоты = 0,15*60=9г
массовая доля кислоты = 9/200=0,045 или 4,5%
т.к. отношения в УХР одномолярные, то и фенола прореагирует 0,25 моль
масса фенола = 0,25*94=23,5г