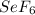Пусть есть раствор массой 100 г. Тогда там 0.02 г H2SO4. Находим количество вещества серной кислоты. n(H2SO4) = 0.02 г / 98(г/моль) = 2.041 * 10^(-4) моль. Здесь пренебрежительно малое количество серной кислоты, поэтому плотность воды = 1000 г/л , практически не искажена. Значит объём раствора равен 0.1 л. Находим молярную концентрацию H2SO4. c(H2SO4) = 2.041 * 10^(-4) моль / 0.1 л = 2.041 * 10^(-3) моль/л с(H[+]) = 2c(H2SO4) = 4.082 * 10^(-3) моль/л Для нахождения концентрации OH[-] разделим ионное произведение воды = 10^(-14) на концентрацию катионов водорода. с(OH[-]) = 10^(-14) / (4.082 * 10^(-3)) = 2.45 * 10^(-12) моль/л Для нахождения pH воспользуемся формулой: pH = -lg( c(H[+]) ) pH = -lg( 4.082 * 10^(-3) ) = 2,389 ( то есть, довольно кислая )
а) У кислорода: если он стоит один то 0 (это у всех, не только у кислорода)
также есть -2 (чаще всего в соединениях он проявляет такую степень окисления) ,
-1 в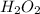 ,
,
+2 в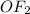 ,
,
так же может быть +4 в аллотропических модификациях кислорода.
б) У серы: -2 в сульфидах, гидросульфидах и сульфидокислотах,
если он стоит один то 0
+4 в тетрагалогенидах например,
+6 в соединениях с наиболее электроотрицательными элементами.
в) У азота: -3 в нитридах
-2 азот проявляет в соединениях перикисного типа,
в соединении под названием гидроксиламин он проявляет степень окисления -1
если он стоит один то 0
также может проявлять степени окисления +1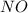 ,
, 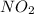 ,
,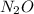
+3 и +5 в фториде, оксидах, оксогалогенидах.
г) Селенах: -2 в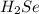 .
. 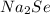
+4 селен проявляет в диоксиде, тетра- и оксогалогенидах
если он стоит один то 0
и в +6 это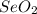 .
.