1.
А. 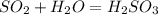
Б. 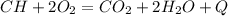
В. 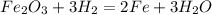
1.
А. 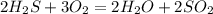
Б. 
В. 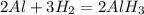
2.
mH2O = 35г
mсоли = 10г
mраствора = mсоли+mводы = 35г+10г = 45г
w = mсоли/mр-ра = 10г/45г*100% = 22,2%
2.
mр-ра = 300г
wсоли = 0,05
mсоли = w*mр-ра = 0,05*300г = 15г
mводы = mр-ра - mсоли = 300-15 = 285г
3.
C -> XH4 -> CO2 -> H2CO3
1. C + 2H2 = CH4 - соединение, обр. метан
2. CH4 + 2O2 = CO2 + 2H2O - разложение, с образованием углекислого газа и воды.
3. CO2 + H2O = H2CO3 - соединение, обр. уголная кислота
3.
Al -> Al2O3 -> Al -> Al(OH)3
1. 4Al + 3O2 = 2Al2O3 - соединение, обр. оксид алюминия.
2. 2Al2O3 --эл. ток--> 4Al + 3O2 - разложение, обр. алюминий и кислород
3. 2Al + 6H2O = 2Al(OH)3 + 3H2 - замещение, обр. гидроксид алюминия и водород.
1)Cr(0) +2H(+1)Cl → Cr(+2)Cl2 + H2(0)
2 HI + 2 e- → 2 H0
(восстановление)
Cr0 - 2 e- → CrII
(окисление)
HCl является окислителем, Cr является восстановителем.
2)4 Cr(0)+ 3 O2(0) → 2Cr(+3)2O3(-2)
4 Cr0 - 12 e- → 4 CrIII
(окисление)
6 O0 + 12 e- → 6 O-II
(восстановление)
Cr является восстановителем, O2 является окислителем.
3)N2(0) + 2Cr(0) → 2Cr(+3)N(-3)
2 N0 + 6 e- → 2 N-III
(восстановление)
2 Cr0 - 6 e- → 2 CrIII
(окисление)
N2 является окислителем, Cr является восстановителем.
4)3S(0) + 2Cr(0) → Cr2(+3)S3(-2)
3 S0 + 6 e- → 3 S-II
(восстановлениe)
2 Cr0 - 6 e- → 2 CrIII
(окисление)
S является окислителем, Cr является восстановителем.
5)3Cl2(0) + 2Cr(0) → 2Cr(+3)Cl3(-1)
6 Cl0 + 6 e- → 6 Cl-I
(восстановление)
2 Cr0 - 6 e- → 2 CrIII
(окисление)
6)2Cr(0) + 3H2(+1)O → Cr2(+3)O3 + 3H2(0)
6 HI + 6 e- → 6 H0
(восстановление)
2 Cr0 - 6 e- → 2 CrIII
(окисление)
H2O является окислителем, Cr является восстановителем.
Cl2 является окислителем, Cr является восстановителем.
Объяснение:
CaC2 + 2H2O = Ca(OH)2 + CH=-CH
3CH=-CH -> C6H6 (t,kat)
C6H6 + F2 -> C6H5F + HF (t,kat)