
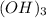 - амфотерный гидроксид,поэтому реагирует с щелочами, кислотами, с основными оксидами(щелочных и щелочноземельных металлов).
- амфотерный гидроксид,поэтому реагирует с щелочами, кислотами, с основными оксидами(щелочных и щелочноземельных металлов).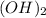 - щёлочь,реагирует с кислот.оксидами,с амфотерными оксидами,с солями(растворимыми),с амфотерными гидроксидами,с кислотами, с металлами(Zn,Al,Be,Sn,Pb) +вода или при сплавлении,с неметаллами.
- щёлочь,реагирует с кислот.оксидами,с амфотерными оксидами,с солями(растворимыми),с амфотерными гидроксидами,с кислотами, с металлами(Zn,Al,Be,Sn,Pb) +вода или при сплавлении,с неметаллами.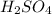 - реагирует с основаниями,с основными оксидами,с амфотерными оксидами,амфот.гидроксидами,с солями,с металлами(в разбавленном и концетрированном виде).
- реагирует с основаниями,с основными оксидами,с амфотерными оксидами,амфот.гидроксидами,с солями,с металлами(в разбавленном и концетрированном виде).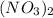 - соль,реагирует с основаниями,кислотами,кисл.оксидами, амф.оксидами,с солями
- соль,реагирует с основаниями,кислотами,кисл.оксидами, амф.оксидами,с солями
первая ступень:
Молекулярное уравнение:
Na2S + H2O ⇄ NaOH + NaHS
Полное ионное уравнение:
2Na+ + S2- + H2O ⇄ Na+ + OH- + Na+ + HS-
Краткое ионное уравнение:
S2- + H2O ⇄ HS- + OH-
вторая ступень:
Молекулярное уравнение:
NaHS + H2O ⇄ NaOH + H2S
Полное ионное уравнение:
Na+ + HS- + H2O ⇄ Na+ + OH- + H2S
Краткое ионное уравнение:
HS- + H2O ⇄ H2S + OH-
2)Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
ионное :Cu2+ + 2ОН- =Cu(OH)2
3)нитрат серебра- реактив для хлорид иона: BaCI2+2AgNO3=Ba(NO3)2+2AgCI↓
ионное:2Ag+ + 2CI-= 2AgCI
4)пишем реакцию, рассчитываем моли :
6,3г 6,3г
KOH + HNO3 → KNO3 + H2O
56г 63г
6,3/56=0,1125 моль KOH
6,3/63=0,1 моль HNO3
Определим среду реакции:
0,1125- 0,1= 0,0125 моль KOH останется лишним после реакции,следовательно среда слабо щелочная( можно написать просто щелочная)
Теперь найдем массу образовавшейся соли, пропорцию составляем с вещ кол-во моль которого меньше:
0,1 моль х=?
KOH + HNO3 → KNO3 + H2O
1 моль 101г
пропорция: 101 ×0,1/1= 10,1 г
ответ:среда реакции щелочная, масса образовавшейся соли 10,1 г
Объяснение: