1. NiSO₄+Ca(OH)₂=Ni(OH)₂↓+CaSO₄
Ni²⁺+SO₄²⁻+Ca²⁺+2OH⁻=Ni(OH)₂↓+Ca²⁺+SO₄²⁻
Ni²⁺+2OH⁻=Ni(OH)₂↓
2RbOH+H₂SO₄=Rb₂SO₄+2H₂O
2Rb⁺+2OH⁻+2H⁺+SO₄²⁻=2Rb⁺+SO₄²⁻+2H₂O
2OH⁻+2H⁺=2H₂O
Hg(NO₃)₂+2NaI=HgI₂↓+2NaNO₃
Hg²⁺+2NO₃⁻+2Na⁺+2I⁻=HgI₂↓+2Na⁺+2NO₃⁻
Hg²+2I⁻=HgI₂↓
Объяснение:
2. NaI +HOH≠ гидролиз не происходит, так как соль образована сильным основание и сильной кислотой. Иодид натрия NaI растворяется в воде при t=25°С в 100г. воды растворяется 184г. иодида натрия.
FeCI₂ хлорид железа(ll) соль, образованая слабым основанием гидроксидом железа(ll) Fe(OH)₂ и сильной cоляной кислотой. Гидролиз таких солей проходит по катиону:
FeCI₂+H-OH = Fe(OH)CI+HCI
Fe²⁺+2CI⁻+H-OH = Fe(OH)⁻+CI⁻+H⁺+CI⁻
Fe²⁺H-OH Fe(OH)⁻+H⁺
Среда раствор кислая. рН < 7
34,5 г
Объяснение:
Дано:
m(FeCl₃) = 100 г
Найти:
m(Fe) - ?
Реакция: 2Fe + 3Cl₂ → 2FeCl₃
Составим пропорцию, учитывая, что и у железа, и у FeCl₃ стоят одинаковые коэффициенты, значит, их количества вещества равны (и их можно сократить)
x 100 г - это массы, т.к. масса железа неизвестна, она x
Fe → FeCl₃
56 162,5 - это молярные массы, находятся по таблице
Менделеева
Ну и теперь крест-накрест и находим массу железа:
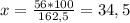 г
г
Виды солей:
1)основные соли
2)нормальные соли
3)кислые соли
4)двойные соли