A5 укажите соли, образованные одной и той же кислотой. 1) nano2, nano3 2) k2co3, khco3 3) baso3, baso4 4) cus, cuso4 a6 с выделением газа протекает реакция между 1) koh и h2so4 2) cuo и hcl 3) k2co3 и hcl 4) nh4cl и agno3 a7 общее количество ионов, образовавшихся при полной диссоциации 1 моль сульфата железа(iii), равно 1) 2 моль 2) 3 моль 3) 4 моль 4) 5 моль a8 с нитратом бария в водном растворе реагирует 1) mgcl2 2) (nh4)2so3 3) febr3 4) kno3 a9 водород при нагревании может реагировать с 1) naoh 2) nacl 3) pbo 4) h3po4 a10 и с азотной кислотой, и с водой может взаимодействовать 1) cao 2) co2 3) cuo 4) sio2 a11 разбавленная серная кислота взаимодействует с 1) zn 2) ag 3) nano3 4) so2 a12 укажите соль, которая может реагировать в водном растворе и с карбонатом натрия, и с нитратом бария. 1) cacl2 2) mgso4 3) agno3 4) k2so4 a13 верны ли следующие утверждения о правилах безопасной работы в школьной лаборатории? а. для получения разбавленной серной кислоты концентрированную кислоту льют в воду, а не наоборот. б. вещества в лаборатории нельзя пробовать на вкус. 1) верно только а 2) верно только б 3) верны оба утверждения 4) оба утверждения неверны a14 наличие сульфат-ионов в растворе можно установить с 1) раствора mg(no3)2 2) лакмусовой бумажки 3) раствора k2co3 4) раствора bacl2 a15 установите соответствие между исходными веществами и продуктами реакции. исходные вещества продукты реакции а) h2so4(конц.) + fe → (при нагревании) 1) feso4 + h2 б) h2so4(разб.) + fe → 2) feso4 + h2o в) h2so4(разб.) + feo → 3) fe2(so4)3 + so2 + h2o 4) fes + so2 + h2o ответ: 1.дана схема превращений: li2o → x → licl → lino3. напишите молекулярные уравнения реакций, с которых можно осуществить указанные превращения. для последней реакции составьте сокращённое ионное уравнение. 2.к 200 г раствора нитрата серебра добавляли раствор хлорида кальция до прекращения выделения осадка. масса отфильтрованного и высушенного осадка составила 28,7 г. рассчитайте массовую долю нитрата серебра в исходном растворе. 3.при прокаливании смеси фосфата кальция с песком и углем получено вещество, которое применяют для изготовления спичек. при сгорании этого вещества образуется «белый дым» – вещество х, которое используют в качестве водоотнимающего средства. запишите уравнения реакций, описанных в тексте. формулу вещества х и назовите его.
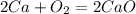
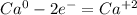 ·2 восстановитель полуреакция окисления
·2 восстановитель полуреакция окисления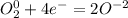 ·1 окислитель полуреакция восстановления
·1 окислитель полуреакция восстановления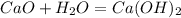
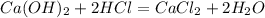
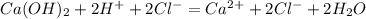
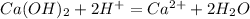
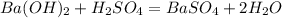
![m[Ba(OH)_2]=](/tpl/images/0276/7725/752a4.png) =50 · 0,18 = 9 г
=50 · 0,18 = 9 г![n[Ba(OH)_2]= \frac{m[Ba(OH)_2]}{M[Ba(OH)_2]} = \frac{9}{171} =0,0526](/tpl/images/0276/7725/43f28.png) моль
моль![n(BaSO_4)=n[Ba(OH)_2]=0,0526](/tpl/images/0276/7725/a4a1c.png) моль
моль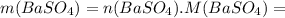 =0,0526 · 233=12,2558 г ≈12,26 г
=0,0526 · 233=12,2558 г ≈12,26 г
Решал точно такое же задание во вторник на пробном ГИА
5.2)
6.3)
7.4)
8.2)
9.3)
10.1)
11.1)
12.2)
13.3)
14.4)
15.А - 3 Б - 1 В - 2
C1.Li2O+H2O=2LiOH
LiOH+HCl=LiCl+H2O
LiCl+AgNO3=LiNO3+AgCl
Li+ + Cl- + Ag+ + NO3- = Li+ + NO3- + AgCl
Cl- + Ag+ =AgCl
C2.2AgNO3+CaCl2=2AgCl+Ca(NO3)2
ню(AgCl)=28.7/143.5=0.2 моль
по УХР ню(AgCl)=ню(AgNO3)=0.2 моль
m(в-ва AgNO3)=0.2*170=34 грамма
w(AgNO3)=34/200=0.17 или 17%
С3. Ca3(PO4)2+5C+3SiO2=2P+3CaSiO3+5CO
4P+5O2=2P2O5
X - P2O5, оксид фосфора V
также уравнением является слово водоотнимающее средство
P2O5+3H2O=2H3PO4