Объяснение:
Высший оксид вида
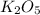
характерен для элементов
V группы а-подгруппы (N, P, As, Sb, Bi)
в таблице Менделеева
Для этих же элементов характерен гидрид вида:
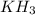
Известно, что в соединении с гидрогеном (водород, Н) массовая доля гидрогена составляет 8.8%.
Напишем уравнение
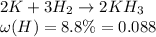
Молекулярная масса КН3 равна:
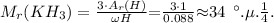
Следовательно, атомная масса элемента К равна:

И действительно в V группе а-подгруппе есть элемент с атомной массой 31 а.е.м.
И этот элемент - фосфор (Р)
Это 15 элемент в Таблице. Его электронная формула имеет вид:
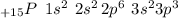
Гидрат оксида фосфора, который соответствует его высшему оксиду (гидроксид фосфора) - это фосфорная кислота, чаще всего имеется в виду ортофосфорная кислота
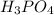
однако может встречаться и метафосфорная кислота
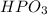
Фосфорная кислота реагирует с
с основными оксидами:
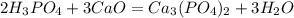
с основаниями:
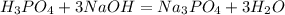
Характерная реакция на фосфат-ионы - взаимодействие с нитратом серебраAgNO3. При этом образуется ярко-желтый осадок фосфата серебра:

Fe3+ + 3OH- = Fe(OH)3
Причина необратимости - образование нерастворимого осадка красно-коричневого цвета гидроксида железа (III)
Опыт 2. CH3COONa + HCl = CH3COOH + NaCl
В данной реакции устанавливается равновесие так как оба получившихся вещества растворимы в воде
Опыт 3. При добавлении индикатора фенолфталеина в щелочь раствор приобретает малиновый цвет. Это обусловлено щелочной реакцией раствора. На данную реакцию уравнения нет.
При добавлении кислоты к щелочи образуется соль и вода (реакция нейтрализации) KOH + HCl = KCl + H2O
H+ + OH- = H2O
(KCl - соль образованная сильным основанием и сильной кислотой следовательно реакция раствора нейтральная)