1) 2Al + 6HCl > 2AlCl3 + 3H2
m(Al) = 2,7 г , m(HCl) = 12,6 г
n(Al) = 2,7 / 27 = 0,1 моль, n(HCl) = 12,6 / 36,5 = 0,345 моль.
> алюминий взят в недостатке.
0,1 - n > n(H2) = 0,15 моль, тогда V(H2) = 22,4 * 0,15 = 3,36 л.
2 3
2) ион алюминия сходя по электронному строению с инертным газом неоном Ne.
3) а) Алюминий не поддается пайке на воздухе, скорее всего, потому что во время пайки на воздухе на поверхности алюминия образуется оксидная плёнка, препятствующая дальнейшей пайке (т.е. образуется оксид алюминия, температура плавления которого больше, чем у простого вещества металла алюминия)
б) Алюминиевая посуда не разрушается в кипящей воде потому что температура плавления алюминия выше, чем температура кипения воды, при этом в пресной воде пищевые сплавы алюминия самопассивируются, образуя на поверхности плёнку оксида, не разрушающуюся при кипячении.
4) а)
1. 2Al + 3Cl2 > 2AlCl3
2. 2Al(амальг.) + 6H2O > 2Al(OH)3 + 3H2
3. 2Al + N2 > 2AlN (при температуре 800 гр.)
4. 2Al + 3S > Al2S3 (при высокой температуре)
5. 4Al + 3C > Al4C3 (при температуре 1000 градусов по Цельсию)
6. 2Al + 6HCl > 2AlCl3 + 3H2
7. Al + NaOH + 3H2O > Na[Al(OH)4] + H2 (щелочь в избытке)
8. Cr2O3 + 2Al > 2Cr + Al2O3 (алюминотермия, при высоких температурах)
5) Al2O3---> Al > Al2(SO4)3 ---> Al(OH)3 ---> Al2O3
1. 2Al2O3 > 4Al + 3O2 (реакция происходит в расплавленном криолите при электролизе)
2. 2Al + 3H2SO4 (разб) > Al2(SO4)3 + 3H2
3. 2Al2(SO4)3 + 12NaOH > 4Al(OH)3 + 6Na2SO4
t
4. 2Al(OH)3 > Al2O3 + 3H2O;
0 +1 +3 0
2Al + 3H2SO4 (разб) > Al2(SO4)3 + 3H2
0 +3
2 Al - 3e > Al - восстановитель, окисляется.
+1 0
3 2H + 2e> H2 - окислитель, восстанавливается.
2Al2(SO4)3 + 12NaOH > 4Al(OH)3 + 6Na2SO4
3+ 2- + - +3 + 2-
4Al + 6SO4 + 12Na + 12OH > 4Al(OH)3 + 12Na + 6SO4
3+ -
4Al + 12OH > 4Al(OH)3.
6) 2Al + 6HCl > 2AlCl3 + 3H2
m(HCl р-ра) = 400 г
m(Al) = 5,4 г
n(Al) = 5,4/27=0,2 моль
n(HCl) = 3n(Al) = 3*0,2 = 0,6 моль, m(HCl) = 36,5*0,6 = 21,9 г.
w%(HCl) = 21,9*100/400 = 5,475 %.
7. Концентрированная азотная кислота на холоде пассивирует алюминий, с конц. азотной кислотой взаимодействует только медь:
Cu + 4HNO3 > Cu(NO3)2 + 2NO2 + 2H2O .
m(Al и Cu) = 10 г.
V(NO2) = 4,48 л, n(NO2) = 4,48/22,4 = 0,2 моль
n(Cu) = 1/2n(NO2) = 0,2/2 = 0,1 моль
m(Cu) = 0,1 * 64 = 6,4 г, тогда m(Al в смеси)= 10 - 6,4 = 3,6 г.
w%(Cu) = 6,4*100/10 = 64%, w% (Al) = 100 - 64 = 36%.
8. Магний с раствором щёлочи не реагирует, реагирует только алюминий:
2Al +2NaOH + 6H2O > 2Na[Al(OH)4] + 3H2.
V(H2) = 1,12 л, n(H2) = 1,12 / 22,4 = 0,05 моль.
n(Al) = 2*0,05/3= 0,03 моль
m(Al) = 0,03*27 = 0,81 г.
m(смеси) = 2,1 г, тогда m(Mg) = 2,1 - 0,81 = 1,29 г.
w%(Al) = 0,81*100/2,1= 38,6 %
w% (Mg) = 100 - 38,6 = 61,4 %.
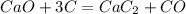
1) al+hcl=alcl2+h2
n(al)=2,7/2=0.1
n(hcl)=12.6/36.5=0.3
=>n(h2)=0.1
V(h2)=0.1*22.4=2.24л
2) Аргон, потому что в 3 периоде аргон единственный благородный газ
3) а)Оксид имеет высокую температуру плавления, отличную от металла алюминия и не поддается пайке б) потому что температура плавления алюм. выше температуры плавления
4) не уверен б) всё кроме 3 и 7; реакции найдешь в википедии
5) 2al203+3c=4al+3co2
2al+3h2so4=al2(so4)3+3h2
al2(so4)3+6naoh=2al(oh)3+3na2so4
2al(oh)3 -->t al2o3+3h2o
* al0 -3e al3+ | 3
h+ +1e h0 |1
*al3+ +3so42- +na+ +oh-=al(oh)3 +3na+ +so42-
al3+ + 3oh-=al(oh)3
6)Al+2hcl=alcl2+h2
n(al)=5.4/27=0.2
=>n(hcl)=0.2*2=0.4
m(hcl)=0.4*36.5=14.6
w(hcl)=14.6/400*100%=3.65%
7)2Al+6hno3=2al(no3)3+3h2
cu+hno3 реакция не идет
n(h2)=4.48/22.4=0.2
=>n(al)=0.2*2/3=0.13
m(al)=0.13*27=3.6
w(al)=3.6/10*100%=36%
8)2Al + 2NaOH + 2Н2О → 3H2 + 2NaAlO2
mg+naoh не реагирует
n(h2)=1.12/22.4=0.05
=>n(al)=0.05*2/3=0.03
m(al)=0.03*27=0.9
w(al)=0.9/2.1*100%=42.9%