Объяснение:
Высший оксид вида
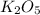
характерен для элементов
V группы а-подгруппы (N, P, As, Sb, Bi)
в таблице Менделеева
Для этих же элементов характерен гидрид вида:
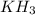
Известно, что в соединении с гидрогеном (водород, Н) массовая доля гидрогена составляет 8.8%.
Напишем уравнение
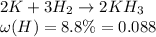
Молекулярная масса КН3 равна:
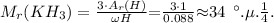
Следовательно, атомная масса элемента К равна:

И действительно в V группе а-подгруппе есть элемент с атомной массой 31 а.е.м.
И этот элемент - фосфор (Р)
Это 15 элемент в Таблице. Его электронная формула имеет вид:
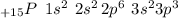
Гидрат оксида фосфора, который соответствует его высшему оксиду (гидроксид фосфора) - это фосфорная кислота, чаще всего имеется в виду ортофосфорная кислота
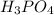
однако может встречаться и метафосфорная кислота
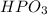
Фосфорная кислота реагирует с
с основными оксидами:
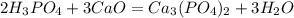
с основаниями:
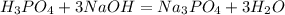
Характерная реакция на фосфат-ионы - взаимодействие с нитратом серебраAgNO3. При этом образуется ярко-желтый осадок фосфата серебра:

все зависит от того, на каком уровне рассматривать это задание, если на школьном, то ответ, что я написал является полным.
Объяснение:
a) FeO + H2SO4 → FeSO4 + H2O
FeO + 2[H+] + [SO4²-] → [Fe²+] + [SO4²-] + H2O
FeO + 2H+ → Fe2+ + H2O;
б) 2HNO3 + Ва(ОН)2 → Ва(NO3)2 + 2H2O
2[H+] + 2[NO3-] + [Ba²+] + 2[OH-] → [Ba²+] + 2[NO3-] + 2H2O
2[H+] + 2[OH-] → 2H2O
в) 3HCl + Al(OH)3 → AlCl3 + 3H2O
3[H+] + 3[Cl-] + [Al³+] + 3[OH-] → [Al³+] + 3[Cl-] + 3H2O
3[H+] + 3[OH] → 3H2O
г) H2SO4 + PbCl2 → PbSO4↓ +2HCl
2[H+] + [SO4²-] + [Pb2+] + 2[Cl-] → PbSO4↓ + 2[H+] + 2[Cl-]
[Pb²+] + [SO4²-] → PbSO4↓
д) Al + H2SO4 ≠
Алюминий не реагирует с конц. азотной и серной кислотой из-за образования пассивирующей пленки на поверхности металла
2Al + 6HCl = 2AlCl3 + 3H2↑
v(al)=1.5
Найдем количество вещества HCL:
2моль - 6моль
1.5 моль - x
x=4.5 моль- HСl
Найдем обьем водорода:
2моль - 3моль
1.5 - xмоль
x=2.25 моль
V=v*M= 2.25* 22.4= 50.4 л -H2
ответ: V(H2)=50.4л, v(hcl)=4.5 моль