У него 10 электронов ,т.к порядковый номер соответствует числе электронов и протонов
1s²2s²2p6
24 г 26,7 г, х г у г
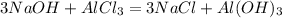
120 г 133,5 г 78 г
1. Сначала определим,какое из исходных веществ прореагирует полностью,т.е. без остатка,приняв,например,массу хлорида алюминия за Х:
для полного взаимодействия 120 г гидроксида натрия необходимо 133,5 г хлорида алюминия, а для --//-- 24 г______________________________х г, откуда
х=24*133,5/120=26,7 г
2. Так как все вещества прореагировали полностью,то массу осадка можно рассчитать по массе любого из исходных веществ:
при взаимодействии 120 г гидроксида натрия образуется 78 г осадка, а
при -- // -- // -- 24 г____________________________у г, откуда
у=24*78/120=15,6 г
1) раз даны вещества, значит пойдет некая реакция, вот она
H2SO4+CA(OH)2 = 2H2O + CaSO4
2)нам известны массы реагирующих везеств, на лицо явно задача на избыток и недостаток, найдем количества веществ, для этого нам потребуется
а)масса H2SO4. Для этого - mр-ра*w= 49гр * 0,5(или на 50%) = 24,5гр
б)v(или n) = m/M = 24,5/98=0,25 моль - это количество вещества H2SO4
в)v(Ca(OH)2)=30.6/74=0.41моль, на лицо явно, что кислота в недостатке, дальнейшие расчеты ведем по ней
3) Из уравнения реакции следует => v(H2SO4) = v(CaSO4) = 0.25 моль
4) Ищем массу CaSO4. m=v*M=0.25моль*136г/моль=34 грамма
5) Ищем массу получившегося раствора, а она равна mр-ра [H2SO4 + mр-раCa(OH)2] - mH2O = (49 + 30.6)-9=70.6 грамм
6) находим w соли
w=34/70.6*100=48%
вроде так
ответ:1s22s22p6
Объяснение: