В результате реакции выпадет осадок сульфата бария BaSO₄ массой 20,97 г.
Объяснение:
Дано:
m(р-ра Al₂(SO₄)₃) = 171 г.
ω (Al₂(SO₄)₃) = 6%
р-р Ba(NO₃)₂ в избытке.
Найти массу осадка.
Решение.
Al₂(SO₄)₃ + 3Ba(NO₃)₂ → 3BaSO₄↓ + 2Al(NO₃)₃
В осадок выпала соль сульфата бария.
1) Вычислим массу сульфата алюминия в 171 г 6% раствора:
m(Al₂(SO₄)₃) = 171 г * 0,06 = 10,26 (г соли находится в растворе)
2) Найдем молярные массы и количества вещества сульфата алюминия и сульфата бария.
M (Al₂(SO₄)₃) = 2 * 27 + 3 * 32 + 16 * 4 * 3 = 342 г/моль
M (BaSO₄) = 137 + 32 + 16*4 = 233 г/моль
Количество вещества сульфата алюминия в растворе:
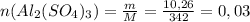 (моль)
(моль)
По уравнению реакции из 1 моль Al₂(SO₄)₃ образуется 3 моль BaSO₄. Из 0,03 моль Al₂(SO₄)₃ образуется 0,03*3 = 0,09 моль BaSO₄.
3) Найдем массу осадка сульфата бария BaSO₄.
m (BaSO₄) = n*M = 0,09 моль * 233 г/моль = 20,97 г.
В результате реакции выпадет осадок сульфата бария BaSO₄ массой 20,97 г.
•NaCl-поваренная соль,является важнейшим сырьем в промышленности.Электролизом из NaCl получают Na,Cl2,NaOH,HCl
•Карбонаты
Карбонат натрия (Na2CO3)-используется для производства бумаги,мыла и стекла
Na2CO3•1”H2O -кристаллическая вода
NaHCO3-гидрокарбонат Na питьевая вода
Na2SO4•10H2O-Глауберова соль
K2CO3-Поташ
Химические свойства:
1.Реагирует с оксидами неметаллов
2NaOH+CO2=Na2CO3+H2O
2.Взаимодействует с кислотами,вступают в реакцию нейтрализации:
NaOH+HCl=NaCl+H2O
3.Вступают в обменные реакции с солями:
2NaOH+CuCl2=Cu(OH)2+2NaCl
4.Взаимодействует с амфотерными оксидами:
NaOH+Al(OH)3=NaAlO2+2H2O