Химическое равновесие сдвигается согласно принципов Ле-Шателье. Сдвинуть равновесие реакции можно , изменяя температуру(если есть температурный эффект-поглощение или выделение тепла), изменением концентрации исходных веществ или продуктов реакции и изменением давления(для газов). В данном уравнении нужно повысить концентрацию NO и Cl2, снизить концентрацию NOCl, снизить температуру(т,к, это экзотермическая реакция) и повысить давление.
правила такие: при повышении температуры равновесие сдвигается в сторону эндотермической реакции(с поглощением тепла).При повышении давления-в сторону меньшего объема(считаем по коэффициентам до и после реакции).Повышение концентрации исходных веществ смещает равновесие в сторону образования продуктов и наоборот-понижение-в сторону исходных.
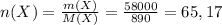 моль
моль
a) Ca(OH)₂+2HNO₃→Ca(NO₃)₂+2H₂O
Ca + 2OH + 2H + 2NO₃ → Ca + 2NO₃ + 2H2O
2OH + 2H → 2H₂O
b) AlCl₃+3KOH→Al(OH₃)↓+3KCl
Al+3Cl + 3K + 3OH → Al(OH₃)↓ + 3K+ 3Cl
Al + 3OH → Al(OH₃)↓
c) K₂CO₃+2HCl→ 2KCl+ H₂O +CO₂↑
2K+2CO₃+2H+2Cl → 2K+2Cl +H₂O+CO₂↑
2CO₃+2H→H₂O+CO₂↑
d) 3MgSO₄+ 2K₃PO₄--> Mg₃(PO₄)₂+ 3K₂SO₄
3Mg+3SO₄+6K+2PO₄→Mg₃(PO₄)₂+6K+3SO₄
3Mg+2PO₄→Mg₃(PO₄)₂