х моль - 0,15 моль
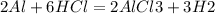
n(H2)=3,36л : 22,4 л/моль=0,15 моль
2 моль - 3 моль
х - n(Al)=0,1 моль
m(Al)=0,1моль* 27г/моль=2,7 г.
Cu c HCl не будет взаимореакций
m(Cu)=5,4-2,7=2,7 г.
w(Cu)=2,7 : 5,4 *100%=50%
ответ: w(Cu)=50%
1. реакция все таки равновесная. обратная реакция используется в промышленности для получения со и водорода и называется углекислотной конверсией метана (правда, приходится добавлять еще и воду, т. к. без воды катализатор быстро закоксовывается, и процесс в целом называют пароуглекислотной конверсией метана)
2. действительно, условий немного не хватает. добавим свои: процесс ведется при постоянной температуре т=const
допустим, смесь находится в сосуде с поршнем и достигла состояния равновесия. для того, чтобы концентрации всех реагирующих веществ уменьшить в 3 раза необходимо в 3 раза увеличить объем. при изотермическом процессе давление уменьшится в 3 раза. поскольку реакция протекает с уменьшением объема, то по принципу ле шателье равновесие должно сместится влево.
х моль 0.15моль
2Al+6HCl=2AlCl3+3H2
n(H2)=3.36л/22,4л/моль=0,15моль
2моль3моль
х-n(Al)=0.1 моль
m(Al)=0.1моль* 27г/моль=2,7 г
Cu c HCl не взаимодействует.
m(Cu)=5.4-2.7=2.7( г)
w(Cu)=2.7/5.4 *100%=50%