для получения азотной кислоты, необходимо смешать ; 4NO2+O2+2H2O=4HNO3
W=mчистого вещества:mобщую*100% из этой формулы следует
m=m*W :100%
подставляем числа
m(HNO3)= 500*10:100%=50
значит маса чистой НNO3= 50 грам.
М-молярна маса
М(НNO3)=4*(1+14+16*3)=63
по даной реакции видно что для получения 50 грам необходимо Х литров NО2
А соотношение молярных мас = 4*22,4 = 63 это значит
50-Х
89,6-63
Х= 3,51 литров необходимо использовать для получения 50 грам НNО3
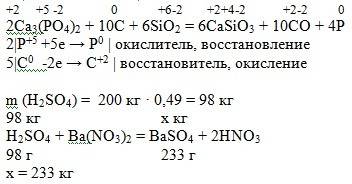
1. Добавим по каплям раствор щёлочи, в пробирке с хлоридом аммония наблюдается выделение газа с резким запахом, поднесенная влажная индикаторная бумажка синеет. В пробирке с хлоридом алюминия наблюдается выпадение осадка, растворимого в избытке щёлочи
NH4Cl+KOH=KCl+H2O+NH3
NH4(+)+OH(-)=H2O+NH3
AlCl3+3KOH=Al(OH)3+3KCl
Al(3+)+3OH(-)=Al(OH)3
Al(OH)3+KOH=K[Al(OH)4]
Al(OH)3+OH(-)=[Al(OH)4](-)
2. К оставшемуся раствору прильём серную кислоту, наблюдается выпадение осадка, нерастворимого в кислотах - в пробирке хлорид бария
BaCl2+H2SO4=BaSO4+2HCl
SO4(2-)+Ba(2+)=BaSO4
Объяснение:
4NO2 + O2 + 2H2O = 4HNO3
Находим массу кислоты: m(HNO3) = w(HNO3) x m(раствора)/100% = 10% х 500г/100% = 50г
Вычисляем количество вещества кислоты: n(HNO3) = m/M = 50г/63г/моль = 0,794моль
По уравнению реакции n(NO2) = n(HNO3) = 0,794моль
V(NO2) = n x Vm = 0,794моль х 22,4л/моль = 17,786 л