
х г 0,56 л
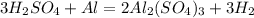
279 г 67,2 л
1. Найдем чистую массу кислоты,необходимую для образования 0,56 л водорода:
при взаимодействии 279 г кислоты выделяется 67,2 л водорода, а
при -- // -- // -- х г_____________________0,56 л, откуда
х=279*0,56/67,2=2,325 г
2. Учитывая,что полученная масса кислоты - это всего лишь 20% в растворе,тогда:
2,325 г кислоты - это 20%, а
у г раствора________100%, откуда у=2,325*100/20=11,625 или приблизительно 12 г
решено правильно. у нас реагирует N2O5 с H2O и получается 2HNO3
решить задачу можно через n2o5 или h20. а чтобы понять с каким именно идет реакция, нужно найти какого из веществ количества вещества меньше! кол-во вещ-ва n2o5 = 0.2 , а h2o = 27.7 моль.
0.4 меньше чем 27.7, значит и будет искать через n2o5
кол-во вещества, т.е. ню или n
n(n2o5)=1 моль (по ур.реакции)
n(hno3)= 2 моль (по ур. реакции)
отсюда n(hno3)=2n(n2o5)
до этого мы находили n(n2o5)=0.2 значит n(hno3)=2*0.2=0.4моль
дальше решения у тебя не правильное! смотри как нужно :)
дальше находим m(hno3)=0.4 * (16*3+14+1)=0.4 * 63=25.2г
находим массу (р-ра)=21.6 + 500 + 25.2= 546,8 г
m(р.в.)=m(hno3)=25.2г
w - массовая доля
w=m(р.в.)/m(р-ра) * 100%
w= 25.2г * 100% / 546,8г =4,6%
ответ: w(hno3)=4.6%