n₁(Li₂O) =0,1моль
Объяснение:
Дано:
m(Li)=1,4г.
----------------------------
n(Li₂O)-?
1. Определим молярную массу лития:
M(Li)=7г./моль
2. Определим количество лития в 1,4г.
n(Li)=m(Li)÷M(Li)=1,4г.÷7г./моль=0,2моль
3. Запишем уравнение реакции:
4Li+O₂=2Li₂O
а) по уравнению реакции количество вещества:
n(Li)=4моль n(Li₂O) =2моль
б) по условию задачи количество вещества:
n₁(Li)=0,2моль n₁(Li₂O) =0,1моль
4. ответ: количество вещества оксида лития образуется при взаимодействии с кислородом 1,4 г лития. 0,1моль
n₁(Li₂O) =0,1моль
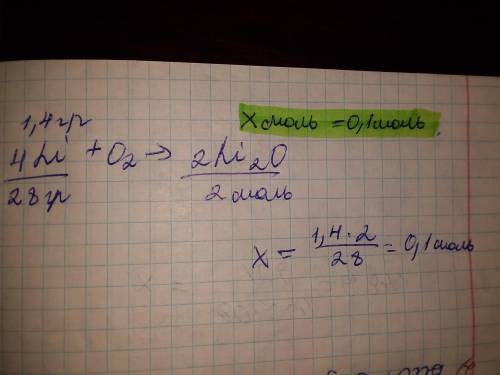
как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? составьте электронные уравнения анодного и катодного процессов.
решение:
а) олово имеет менее отрицательный стандартный электродный потенциал (-0,14 в), чем железо (-0,44 в), поэтому оно является катодом, железо – анодом. при контакте олова и железа в атмосфере разрушаться будет железо:
анодный процесс: fe0 - 2электрон = fe2+
катодный процесс в нейтральной среде: 1/2o2 + h2o + 2электрон = 2oh-
так как ионы fe2+ с гидроксид-ионами он- образуют нерастворимый гидроксид, то продуктом коррозии будет fe(oh)2.
б) цинк имеет более отрицательный стандартный электродный потенциал (-0,763 в), чем железо (-0,44 в), поэтому он является анодом, железо – катодом.
анодный процесс: zn0 - 2электрон = zn2+
катодный процесс в нейтральной среде: 1/2o2 + h2o + 2электрон = 2oh-
так как ионы zn2+ с гидроксид-ионами он- образуют нерастворимый гидроксид, то продуктом коррозии будет zn(oh)2.