Задание 1:
1) Сложные вещества, состоящие из двух элементов, один из которых кислород - ОКСИДЫ
2) Сложные вещества, состоящие из разных по виду атомов химических элементов - СЛОЖНЫЕ ВЕЩЕСТВА
3) Вещества, состоящие из ионов металла и гидроксильных групп - ОСНОВАНИЯ
4) Вещества, состоящие из ионов металла и кислотных остатков - СОЛИ
5) Вещества-распознаватели кислот и щелочей - ИНДИКАТОРЫ
Задание 2:
1) в глаз попала кислота - промыть глаза большим количеством воды около 30 минут
2) если на кожу попала кислота - промыть большим количеством воды, после промыть раствором пищевой соды
3) ожог щелочами - промыть водой, после раствором лимонной, уксусной или борной кислоты
Задание 3:
А - 4
Б - 5
В - 1
Г - 2
Д - 3
Задание 4:
А. Лишнее Cu(OH)₂, потому что из всех перечисленных оснований оно единственное не растворимо в воде
Б. Лишнее LiOH, потому что из всех перечисленных оснований в этом основании единственный металл имеет степень окисления +1, когда все остальные +2
В. Лишнее Al(OH)₃, потому что из всех перечисленных оснований, во-первых, это нерастворимое, во-вторых, металл в нем имеет степень окисления +3, когда все остальные +1
Задание 5:
а) оксиды: CO₂ (оксид углерода (IV)), Al₂O₃ (оксид алюминия), Na₂O (оксид натрия)
б) основания: NaOH (гидроксид натрия или едкий натр), Fe(OH)₃ (гидроксид железа (III)), Ba(OH)₂ (гидроксид бария)
в) кислоты: HNO₃ (азотная кислота), H₂CO₃ (угольная кислота)
г) соли: K₂SO₄ (сульфат калия), Mg₃(PO₄)₂ (фосфат магния), CuCl₂ (хлорид меди)
Задание 6:
Формула: 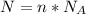 , где
, где 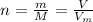 - количество вещества (моль);
- количество вещества (моль); 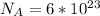 - число Авогадро (1/моль).
- число Авогадро (1/моль).
M - молярная масса (считается как сумма атомных масс элементов, входящих в вещество; атомные массы даны в таблице Менделеева)
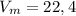 - молярный объем, одинаковый для всех газов при н.у. (л/моль)
- молярный объем, одинаковый для всех газов при н.у. (л/моль)
Считаем:
а) 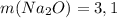 г
г
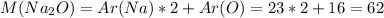 г/моль
г/моль
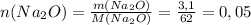 моль
моль
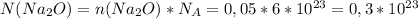 молекул
молекул
б) 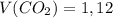 л
л
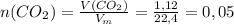 моль
моль
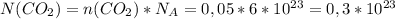 молекул
молекул
Задание 1:
1) Сложные вещества, состоящие из двух элементов, один из которых кислород - ОКСИДЫ
2) Сложные вещества, состоящие из разных по виду атомов химических элементов - СЛОЖНЫЕ ВЕЩЕСТВА
3) Вещества, состоящие из ионов металла и гидроксильных групп - ОСНОВАНИЯ
4) Вещества, состоящие из ионов металла и кислотных остатков - СОЛИ
5) Вещества-распознаватели кислот и щелочей - ИНДИКАТОРЫ
Задание 2:
1) в глаз попала кислота - промыть глаза большим количеством воды около 30 минут
2) если на кожу попала кислота - промыть большим количеством воды, после промыть раствором пищевой соды
3) ожог щелочами - промыть водой, после раствором лимонной, уксусной или борной кислоты
Задание 3:
А - 4
Б - 5
В - 1
Г - 2
Д - 3
Задание 4:
А. Лишнее Cu(OH)₂, потому что из всех перечисленных оснований оно единственное не растворимо в воде
Б. Лишнее LiOH, потому что из всех перечисленных оснований в этом основании единственный металл имеет степень окисления +1, когда все остальные +2
В. Лишнее Al(OH)₃, потому что из всех перечисленных оснований, во-первых, это нерастворимое, во-вторых, металл в нем имеет степень окисления +3, когда все остальные +1
Задание 5:
а) оксиды: CO₂ (оксид углерода (IV)), Al₂O₃ (оксид алюминия), Na₂O (оксид натрия)
б) основания: NaOH (гидроксид натрия или едкий натр), Fe(OH)₃ (гидроксид железа (III)), Ba(OH)₂ (гидроксид бария)
в) кислоты: HNO₃ (азотная кислота), H₂CO₃ (угольная кислота)
г) соли: K₂SO₄ (сульфат калия), Mg₃(PO₄)₂ (фосфат магния), CuCl₂ (хлорид меди)
Задание 6:
Формула: 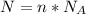 , где
, где 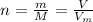 - количество вещества (моль);
- количество вещества (моль); 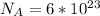 - число Авогадро (1/моль).
- число Авогадро (1/моль).
M - молярная масса (считается как сумма атомных масс элементов, входящих в вещество; атомные массы даны в таблице Менделеева)
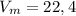 - молярный объем, одинаковый для всех газов при н.у. (л/моль)
- молярный объем, одинаковый для всех газов при н.у. (л/моль)
Считаем:
а) 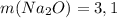 г
г
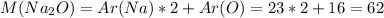 г/моль
г/моль
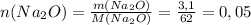 моль
моль
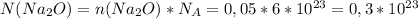 молекул
молекул
б) 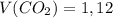 л
л
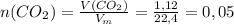 моль
моль
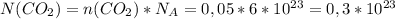 молекул
молекул
лшшщшшш в России и СНГ мы уже не помню как я могу сделать для вас