4Al(NO₃)₃ = 2Al₂O₃ + 12NO₂ + 3O₂
4Fe(NO₃)₂ = 2Fe₂O₃ + 8NO₂ + O₂
Определим состав газовой смеси:
Пусть а - мольная доля NO₂ в смеси, 1-а - мольная доля O₂ в смеси,
М(смеси) = 11*4 = 44 г/моль
44 = 46*а + (1-а)*32
а=6/7 мольная доля NO₂ в смеси и 1/7 мольная доля O₂ в смеси, т.е в смеси NO₂ в 6 раз больше, чем O₂
Пусть в смеси нитратов было х моль Al(NO₃)₃ и у моль Fe(NO₃)₂. Тогда образовалось
3х + 2у моль NO₂ и (3/4 х +1/4 у)моль O₂
(3х + 2у) / (3/4 х +1/4 у) = 6
у = 3х
Пусть х = 1 моль Al(NO₃)₃, тогда в смеси 3 моль Fe(NO₃)₂
Масса смеси = 213 +3*180 =753 г
w(Al(NO₃)₃) = 213 / 753 =0,2829, или 28,29%
ответ: А
Разложение гашеной извести: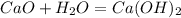
Если тепловой эффект разложения гашеной извести составляет 108кДж/моль, а по условию было использовано 81 кДж, то в реакцию вступило 0,75 моль гашеной извести и было получено 0,75 моль СаО и 0,75 моль воды (что равно 18*0,75=13,5 г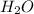 )
)
В следующую реакцию - реакцию взаимодействия негашеной извести СаО с раствором фосфорной кислоты: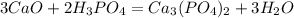 вступило 0,1*147=14,7 г фосфорной кислоты
вступило 0,1*147=14,7 г фосфорной кислоты 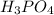 .
.
Молярная масса фосфорной кислоты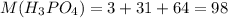 г/моль .
г/моль .
Тогда в реакцию вступило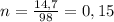 моль фосфорной кислоты и 0,225 моль негашеной извести и получилось 0,075 моль фосфата кальция.
моль фосфорной кислоты и 0,225 моль негашеной извести и получилось 0,075 моль фосфата кальция.
При этом в растворе осталось 0,75-0,225=0,525 моль или 0,525*56 =29,4г СаО, а также 13,5 + 147*0,9 =145,8 г воды.
Молярная масса фосфата кальция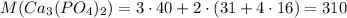 г/моль
г/моль
Тогда масса получившейся соли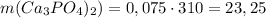 г.
г.
Масса раствора равна 23,25+145,8 + 29,4 = 198,45 г,
а массовая доля соли составляет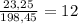 %
%