ответ:
объяснение:
поваренная соль (хлористый натрий, хлорид натрия) - nacl
едкий натр (каустик, едкий натр, едкая щёлочь, гидроксид натрия) - naoh
каустическая сода - naoh (см. выше)
едкое кали (гидроксид калия) - koh
кристаллическая сода - под этим названием понимают гидраты карбоната натрия, в первую очередь, натрит — na₂co₃ * 10 h₂o, реже - другие кристаллогидраты - na₂co₃ * 7 h₂o и na₂co₃ * h₂o - термонатрит.
питьевая сода (пищевая сода, бикарбонат натрия, натрий двууглекислый, гидрокарбонат натрия) - nahco₃
кальцинированная сода (бельевая сода, карбонат натрия) - na₂co₃
поташ ((углекислый калий, карбонат калия) - k₂co₃
негашеная известь («кипелка», оксид кальция) - cao
жженая магнезия (периклаз, оксид магния) - mgo
гашеная известь (гидроксид кальция) - ca(oh)₂
известковая вода - прозрачный раствор гидроксида кальция ca(oh)₂,
получаемый при фильтровании известкового молока.
мел, мрамор, известняк (карбонат кальция) - caco₃
гипс ( алебастр, гидрат сульфата кальция) - caso₄ * 2 h₂o
корунд (сапфир, рубин, наждак (в смеси с магнетитом fe₃o₄), оксид алюминия) - al₂o₃
глинозем - al₂o₃ (см. выше)
медный купорос (медь сернокислая пятиводная, пентагидрат сульфата меди (ii)) - cuso4·5 h₂o
озон - o₃
плавиковая кислота (фтороводородная кислота) - hf
пирит (серный колчедан, железный колчедан, дисульфид железа, персульфид железа) - fes₂
калиевая, натриевая, аммиачная селитра (нитраты калия, натрия, аммония) - kno₃, nano₃, nh₄no₃
угарный газ (оксид углерода (ii), монооксид углерода) - co
кварц, кварцевый песок, речной песок, кремнезём, горный хрусталь (двуокись кремния, оксид кремния (ii)) - sio₂
силан (кремневодород) - sih₄
фосфин (фосфористый водород, гидрид фосфора, фосфан, фосфид водорода) - ph₃
подробнее - на -
Наибольшим сродством к электрону обладает фтор.
Объяснение:
Заметна тенденция увеличения значения сродства к электрону по продвижению по периоду.
Эту тенденцию можно объяснить с точки зрения эффективного заряда ядра: двигаясь в пределах периода, происходит увеличение эффективного заряда ядра, если электрон чувствует значительное притяжение к ядру, то при его добавлении к нейтральному атому будет выделяться больше энергии.
Таким образом, энергия, выделяемая при добавлении электрона к нейтральным атомам азота, кислорода и фтора будет равна: 0; -141; -328 кДж/моль, соответственно. Видно, что переходе от азота к фтору, выделяется больше энергии, поэтому фтор имеет наибольшее значение электронного сродства.
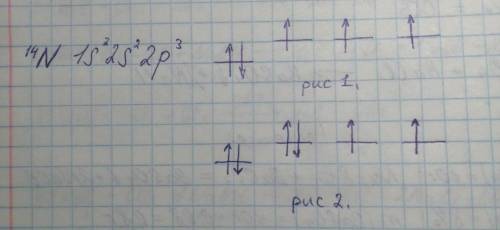
Вы обратили внимание, что выделяемая азотом энергия, при добавлении к нему электрона, равна 0, это легко объясняется, если расписать электронную конфигурацию данного атома:
Электронная конфигурация атома азота представлена на рисунке.
На рис 1. изображены S и P орбитали нейтрального атома азота, по два электрона на S-орбитали и по одному на P-орбиталях.
На рис 2. иллюстрируется добавление электрона к нейтральному атому азота, он будет добавлен на одну из P-орбиталей, на которых уже есть электрон.
Таким образом, электрон, добавленный на одну из этих орбиталей будет отталкиваться от уже находящегося на орбитали электрона. Это и является причиной того, что тенденция непоследовательна - у азота нет сродства к добавленному электрону.
Свежего воздуха в зону химических реакций и удаление из неё образующиеся продуктов . Этот процесс называется газообменом