Ca(SO4)- сульфид кальция.
дано:
14,4г
Ca(SO4)
Найти:
n-?
1) М(Ca(SO4)= 40+32+16x3=120 г\моль
2)вычислим по формуле: n=m\M
n= 14,4\120=0,12 моль
ответ: n(Ca(SO4)=0,12 моль
15% = 0,15
10% = 0,1
P.S.: остальные данные переводить не надо
найдем массу гидроксида калия:
m (KOH) = 100*1,1*0,15 = 16,5 г
найдем количество вещества гидроксида калия:
n (KOH) = 16,5/56 = 0,29 моль
найдем массу хлороводорода:
m (HCl) = 150*1,05*0,1 = 15,75 г
найдем количество вещества хлороводорода:
n (HCl) = 15,75/36,5 = 0,43 моль
составим уравнение реакции: KOH + HCl = KCl + H2O
найдем массу хлорида калия:
m (KCl) = 74,5*0,29 = 21,6 г
найдем массу раствора:
m (р-ра) = 100*1,1 + 150*1,05 = 267,5 г
найдем искомую массовую долю:
"амега" (KCl) = 21,6/267,5*100% = 8,07%
Задачу могу решить если хочешь могу через "х", а могу и проще(на мой взгляд)
Простой Общая масса веществ до рекции = массе веществ после реакции.
19,6г=16г+m(H2O)
m(H2O)=19,6-16
m(H2O)=3,6г
M(H2O)=1+1+16=18г/моль
находим количество вещества воды n=m/M
n=3,6/18
n=0,2моль
за уравнением рекции видно, что (MeO):n(H2O)=1:1
Находим массу этого оксида. n(MeO)=m(MeO)/х
0,2моль=16г/х
х=16г/0,2моль
х=80г/моль - это молярная масса ВСЕГО оксида
Как же найти молярную массу металла?? Да очень легко! От молярной массы всего оксида отнять массу оксигена.
Ar(O)=16г/моль
M(Me)=M(MeO)-Ar(O)
M(Me)=80г/моль-16г/моль
M(Me)=64 г/моль
По всей видимости тот металл, что мы искали - Zn(цинк). Так как он проявляет валентность 2 и его масса 65г/моль наиболее близка до 64.
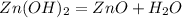
CaS - сульфид кальция
M (молярная масса) = 40+32=72 г/моль
m (масса) = 14,4 г
n (кол-во в-ва) = m/M = 14,4 : 72 = 0,2 моль (ответ)