хлорид натрия по-моему когда я написала вроде правильно было учитель сказал правильно если не правильно сор
Самый простой взять универсальную индикаторную бумагу( 3 шт) и аккуратно, немного ее смочить в пробирках-1 бумажечка- 1 пробирка, соответственно. В пробирке с серной кислотой будет красное окрашивание (или темно-малиновое, восприятие цветв у всех разное), в пробирке с нитратом калия-окрашивания не будет( цвет останется прежним), в пробирке с гидроксидом натрия- синий(если концентрированный раствор щелочи) или зеленый, если концентрация щелочи небольшая.
Объяснение:
Можно взять другой индикатор- фенолфталеин: он отлично покажет натрий гидроксид( раствор станет малинового цвета), а вот кислоту(а) и соль(б)- мы не обнаружим, потому что растворы останутся прозрачными. Так что еще пригодятся 2 небольшых гранулы цинка или алюминия. Положим по одной в пробирку а и б. В пробирке с кислотой начнут образовываться пузырьки газа- это выделяется водород (H2) : Zn +H2SO4(разб)-> ZnSO4 + H2, такая же реакция с алюминием, но только необходимо учитывать, что в концентрированной серной кислоте эти металлы пассивируют и реакции почти не видно, поскольку довольно быстро металлы покрываются защитной пленкой оксида: ZnO или Al2O3. Так что этот вариант подойдет для разбавленного раствора серной кислоты
10%
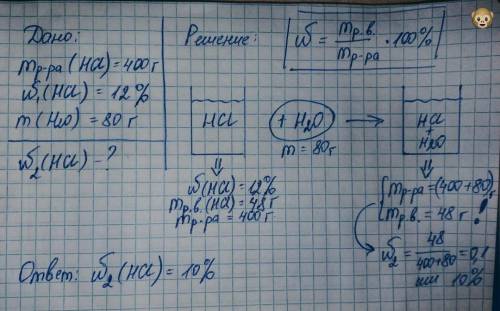
Решение во вложении↓
Объяснение:
Вначале у нас есть стаканчик с раствором кислоты. Раствор весит 400 г. Известно, что доля кислоты относительно всего раствора 12%. Значит, по обведенной формуле можно рассчитать сколько граммов кислоты (НЕ РАСТВОРА, а порошка, например) было потрачено на приготовление этого раствора. Получили 48 г соляной кислоты было взято для приготовления 400 г раствора (кислоту растворили в воде и получился раствор).
Далее этот раствор разбавили еще некоторым количеством воды (по заданию 80 г). Надо понимать, что нового количества кислоты не добавили, оно так и осталось 48 г, а вот раствор изначально весил 400 г, а к нему прилили еще воды, следовательно, раствор стал весить больше: 400+80 = 480 г. Если изменился вес раствора, значит доля кислоты относительно раствора изменилась, потому что раствор разбавили. Масса растворенного вещества осталась та же (48 г), массу раствора посчитали (480 г). По формуле поделили, умножили на 100 → получили массовую долю кислоты 10%.
Видимо, имеется в виду Na2SiO3.
Na2SiO3 + H2O = NaHSiO3 + NaOH
или в ионной форме:
2Na(+) + SiO3(2-) + H2O = Na(+) + HSiO3(-) + Na(+) + OH(-)
SiO3(2-) + H2O = HSiO3(-) + OH(-)
Гидролиз идет по аниону, наличие ионов OH(-) дает щелочную среду.
Гидролиз может идти более глубоко:
HSiO3(-) + H2O = H2SiO3 + OH(-)
2) AlCl3, запишем гидролиз только по первой стадии:
AlCl3 + H2O = AlOHCl2 + HCl
в ионной форме:
Al(3+) + 3Cl(-) + H2O = AlOH(2+) + 2Cl(-) + H(+) + Cl(-)
Al(3+) + H2O = AlOH(2+) + H(+)
Гидролиз идет по катиону, наличие ионов Н(+) дает кислую среду.
Гидролиз может протекать и более глубоко:
AlOH(2+) + H2O = Al(OH)2(+) + H(+) (вторая ступень)
Al(OH)2(+) H2O = Al(OH)3 + H(+)
3) K2S + H2O = KHS + KOH
ионная форма:
2K(+) + S(2-) + H2O = K(+) + HS(-) + K(+) + OH(-)
S(2-) + H2O = HS(-) + OH(-)
Гидролиз идет по аниону, наличие OH(-) дает щелочную среду.
Гидролиз может идти более глубоко:
HS(-) + H2O = H2S + OH(-)
Обычно для определения среды и типа гидролиза достаточно только первой стадии.