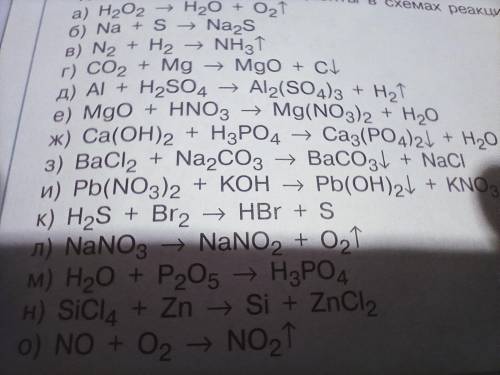
Объяснение:
В атомі Сульфуру перший і другий енергетичні рівні завершені. В атомі Сульфуру є 6 валентних електронів.. Сульфур — р – елемент. На зовнішньому енергетичному рівні атома Сульфуру є 6 електронів, тому він належить до неметалічних елементів. Проста речовина сірка — неметал. Оскільки в атомі Сульфуру два неспарені електрони (основний стан атома), то мінімальне значення валентності дорівнює II. Можливі валентності – II, IV, VI У зв’язку із наявністю в атомі Сульфуру вільних cZ-орбіталей, існує можливість переходу одного електрона із Зр-орбіталі у Зс£-ор-біталь (перший збуджений стан атома)
a 2H2O2=2H2O+O2 разложение
б 2Na+S=Na2S соединение
в N2+3H2=2NH3 соединение
г СО2+2Mg=2MgO+C замещение
д 2Al+3H2SO4=Al2(SO4)3+3H2 замещение
е MgO+2HNO3=Mg(NO3)2+H2O обмен
з BaCl2+Na2CO3=BaCO3+2NaCl обмен
и Pb(NO3)2+2KOH=Pb(OH)2+2KNO3 обмен
к H2S+Br2=2HBr+S замещение
л 2NaNO3=2NaNO2+O2 разложение
м 3H2O+P2O5=2H3PO4 соединение
н SiCl4+2Zn=Si+2ZnCl2 замещение
о 2NO+O2=2NO2 соединение