Привет! Сейчас решим
Оксиды щелочных металлов имеют общую формулу Me2O. Составим уравнения реакции
Me2O + 2HCl = 2MeCl + H2O
Рассчитаем массу кислоты.
m(р-ра) = 278,9*1,047 = 292 г
m(HCl) = 292*0,1 = 29,2 г
Как видно из уравнения реакции, 1 моль оксида реагирует с двумя моль к-ты. Рассчитаем её количество
n(HCl) = 29,2:36,5 = 0,8 моль. Значит, n(Me2O) = 0,4 моль
m(MeO2) = 24,8 (0,4 моль). Отсюда следует, что
M(Me2O) = 24,8:0,4 = 62 г/моль. Два атома металла весят 62-16 = 46. Следовательно, M(Me) = 46:2 = 23 г/моль. Это Na - натрий
Готово! Есть вопросы? Напиши и я отвечу

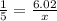
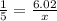
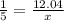
1) Mr(SiH) = Ar(Si) + Ar(H) = 28+1=29
Качественный состав: Кремний, водород.
Количественный состав: 1 атом Si, 1 атом H.
2) Mr(CaCO3) = Ar(Ca) + Ar(C) + 3xAr(O) = 40+12+3x16= 100
Качественный состав: Кальций, карбон, оксиген.
Количественный состав: 1 атом Ca, 1 атом C, 3 атома O.