Задача 1.
х г у г 22 г
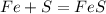
56 г 32 г 88 г
1. При взаимодействии 56 г железа образуется 88 г сульфида, а
при --//--//--//-- х г__________________22 г, откуда
х=56*22/88=14 г
2. При взаимодействии 32 г серы образуется 88 г сульфида, а
при --//--//--//-- у г________________22 г, откуда
у=32*22/88=8 г
Задача 2.
13 г х г у г
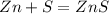
65 г 32 г 97 г
1. Для полного взаимодействия 65 г цинка необходимо 32 г серы, а
для --//--//--//--//--//-- 13 г_________________х г, откуда
х=13*32/65=6,4 г
2. При взаимодействии 65 г цинка образуется 97 г сульфида, а
при --//--//--//--//-- 13 г________________у г, откуда
у=97*13/65=19,4 г
Хлор — химический элемент с атомным номером 17. Принадлежит к 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится в третьем периоде таблицы. Атомная масса элемента 35,446...35,457 а. е. м. Обозначается символом Cl. Химически активный неметалл. Входит в группу галогенов. Простое вещество хлор при нормальных условиях — ядовитый газ желтовато-зелёного цвета, тяжелее воздуха, с резким запахом и сладковатым, «металлическим» вкусом. Молекула хлора двухатомная (формула Cl2).
Объяснение:
План характеристики елемента за його положенням у Періодичній системі та будовою атома.
І. Назва елемента, його символ, відносна атомна маса.
ІІ. Положення у Періодичній системі:
* порядковий номер;
* номер періоду;
* номер групи, підгрупа.
ІІІ. Будова атома:
* заряд ядра та його склад(кількість протонів і нейтронів);
* кількість електронів;
* кількість електронних шарів і розподіл у них електронів;
* електронна формула(конфігурація) та схема будови атома;
* будова зовнішнього електронного шару, його завершеність, кількість спарених і неспарених електронів.
ІV. Характер хімічного елемента:
* s-, p-, d- чи f-елемент;
* металічний чи неметалічний елемент
V. Проста речовина (метал чи неметал):
* формула;
VI.Вищий оксид:
* формула;
* валентність елемента в ньому;
* місце у класифікації (характер);
VII. Гідрат вищого оксиду :
* формула:
* валентність елемента в ньому;
* місце у класифікації (характер);
VIII. Сполука Гідрогену і валентність елемента в ній.
IX. Порівняння металічних або неметалічних властивостей із властивостями елементів, що стоять поряд у періоді та групі.