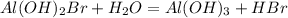Комлексный ион [Ag(NH3)2]+ диссоциирует по уравнению: [Ag(NH3)2]+ = Ag+ + 2NH3 (Кн=[Ag+]*[NH3]^2/[[Ag(NH3)2]+]=7.2*10^-8); в 1 л 0.1 М раствора нитрата диамминсеребра [Ag(NH3)2]NO3 сод-ся соответственно по 0.1 молю ионов [Ag(NH3)2]+ и (NO3)-;
1) найдем мол-ю концесцецию ионов Ag+ и мол-л NH3 на основе Кн: Ag+ = 2√7.2*10^-8*0.1 = 8.4853*10^-5 моль/л, NH3 = 2√8.4853*10^-5 = 9.2116*10^-3 моль/л;
2) считая, что добавление 1.5 г KCl (M=74.5 г/моль, n Cl-=n KCl=1.5/74.5=2.01*10^-2 моль) не увеличит объем роствора, найдем конц-ию ионов Ag+, при которой осадок AgCl не образовался: ПР AgCl = 1.8*10^-10, след-но, с учетом конц-ии Cl-, конц-ия Ag+ сос-т 1.8*10^-10/2.01*10^-2 = 9*10^-9 моль/л;
3) конц-ия Ag+, созданная за счет диссоциации комплексного иона [Ag(NH3)2]+, превышает допустимую для условия невыпадения осадка AgCl конц-ию Ag+ в 8.4853*10^-5/9*10^-9=9.428*10^3 раз; следовательно конц-ию молекул NH3 в соот-ии с условиями задачи и выражением Кн необходимо увеличить в 2√9.428*10^3=97 раз, т.е. новая конц-ия молекулл NH3 состоит 9.2116*10^-3*97=0.8935 моль/л (15.1895 г), следовательно нужно добавить 0.8935-0.0092116=0.8842884 моль NH3 (15.0329028 г);
ответ: в 1 л 0.1 М раствора нитрата диамминсеребра [Ag(NH3)2]NO3 должно содержаться 15.1895 г NH3, для этого в исходный раствор надо добавить 15.0329028 г NH3.
Начнем - с.
Гидролиз пойдет по аниону -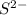
1 - ступень:
Молекулярный Вид:
2 - ступень:
Молекулярный вид:
гидролиз пойдет по катиону -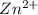
1 - ступень:
МВ: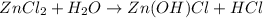
2 - ступень:
МВ: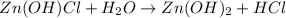
1 - ступень:
МВ:
2 - ступень:
МВ: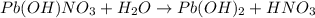
1 - ступень:
МВ: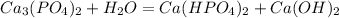
2 - ступень:
МВ: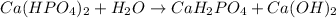
3 - ступень:
МВ: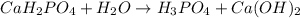 среда щелочная, лакмус синий
среда щелочная, лакмус синий
МВ: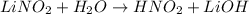
1 - ступень:
МВ:
2 ступень:
МВ: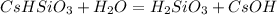
1 - ступень:
МВ: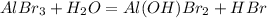
2 - ступень:
МВ:
3 - ступень
МВ: