
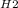 (в дальнейшем я буду писать просто D, а ты пиши как в первом случае)
(в дальнейшем я буду писать просто D, а ты пиши как в первом случае)акономерности изменения химических свойств элементов и их соединений по периодам и группам.
Перечислим закономерности изменения свойств, проявляемые в пределах периодов:
- металлические свойства уменьшаются;
- неметаллические свойства усиливаются;
- степень окисления элементов в высших оксидах возрастает от +1 до +7 (+8 для Оs и Ru);
- степень окисления элементов в летучих водородных соединениях возрастает от -4 до -1;
- оксиды от основных через амфотерные сменяются кислотными оксидами;
- гидроксиды от щелочей через амфотерные сменяются кислотами.
Д. И. Менделеев в 1869 г. сделал вывод – сформулировал Периодический закон, который звучит так:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов.
Систематизируя химические элементы на основе их относительных атомных масс, Менделеев уделял большое внимание также свойствам элементов и образуемых ими веществ, распределяя элементы со сходными свойствами в вертикальные столбцы – группы.
Иногда, в нарушение выявленной им закономерности, Менделеев ставил более тяжелые элементы с меньшими значениями относительных атомных масс. Например, он записал в свою таблицу кобальт перед никелем, теллур перед йодом, а когда были открыты инертные (благородные) газы, аргон перед калием. Такой порядок расположения Менделеев считал необходимым потому, что иначе эти элементы попали бы в группы несходных с ними по свойствам элементов, в частности, щелочной металл калий попал бы в группу инертных газов, а инертный газ аргон – в группу щелочных металлов.
Д. И. Менделеев не мог объяснить эти исключения из общего правила, не мог объяснить и причину периодичности свойств элементов и образованных ими веществ. Однако он предвидел, что эта причина кроется в сложном строении атома, внутреннее строение которого в то время не было изучено.
В соответствии с современными представлениями о строении атома, основой классификации химических элементов являются заряды их атомных ядер, и современная формулировка периодического закона такова:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
Периодичность в изменении свойств элементов объясняется периодической повторяемостью в строении внешних энергетических уровней их атомов. Именно число энергетических уровней, общее число расположенных на них электронов и число электронов на внешнем уровне отражают принятую в Периодической системе символику, т. е. раскрывают физический смысл номера периода, номера группы и порядкового номера элемента.
Строение атома позволяет объяснить и причины изменения металлических и неметаллических свойств элементов в периодах и группах.
Периодический закон и Периодическая система химических элементов Д. И. Менделеева обобщают сведения о химических элементах и образованных ими веществах и объясняют периодичность в изменении их свойств и причину сходства свойств элементов одной и той же группы.
Эти два важнейших значения Периодического закона и Периодической системы дополняет еще одно, которое заключается в , т.е. предсказывать, описывать свойства и указывать пути открытия новых химических элементов
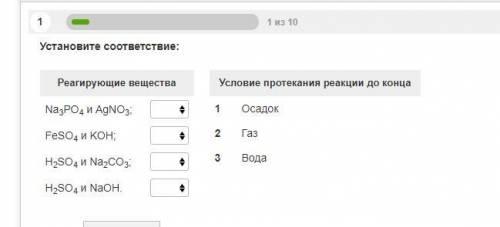
1.Осадок, осадок, газ, вода
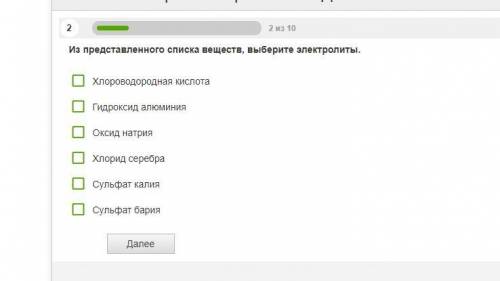
2. Хлороводородная кислота и сульфат калия
3.Аl3++3OH-=Al(OH)3