1) Оксиды (содержат в своем составе кислород): SO2, P2O5, MgO
Кислоты (содержат водород Н и кислотный остаток): H2SO4, H2S, HNO3
Основания (содержат металл и гидроксогруппу OH): Cu(OH)2, Fe(OH)2, KOH
Соли (металл + кислотный остаток): Fe(NO3)3, CuCl2, Na2CO3, K2SO3, CuSO4
2) Возможны любые уравнения с данными реагентами, при условии соблюдения химических свойств (напр. кислота + осн. оксид ⇒ соль + вода; щелочь + соль ⇒ др. соль + др. основание и т.д.)
3) 66 г
CO2
n = 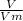 ⇒ V = Vm * n, где V - объем, n - количество в-ва, Vm - постоянная величина, равная 22,4 л
⇒ V = Vm * n, где V - объем, n - количество в-ва, Vm - постоянная величина, равная 22,4 л
n = 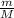
M (CO2) = 12 + 16*2 = 44 г/моль
n (CO2) = 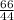
n (CO2) = 1,5 моль
V (CO2) = 1,5 моль * 22.4 л/моль
V (CO2) ≈ 33,6 л
в скобках я буду писпть о силе электролита сил - сильный, слаб - слабый
сильные электролиты дисоциируются на ионы(для этого нужно пользоваться таблицей растворимости и также нужно знать сильные кислоты )
это на будующее / сильные кислоты : HI, HBr,HCL,H2SO4,HNO3,HCLO4,HMnO4, HCLO3
не дисоциируются на электролиты : Осодки(не растворимые соли, основания/гидроксиды) газы и вода (учителя любят спрашивать про воду. Вода это ЭЛИКТРОЛИТ только очень СЛАБЫЙ и по этому он НЕ дисоциирует)
если перед элементом стоит (/) то это означает что его нужно вычеркнут /сократить/подчеркнуть
1)2KOH(сил)+2HNO3(сил)= 2KNO3(сил)+ H2O (слаб)
+ - + - + -
2К/ + OH+ 2H + 2NO3/ = 2K/+2NO3/ +H2O
+ -
2Н+ОН=Н2О
2) HCL+HNO3= (не может быть осуществлена т.к. кислота с кислотой не взаимодействует )
3) Ba(OH)2(сил)+CuCl2(сил)= Cu(OH)2(осадок стрелка вниз)(слаб)+ BaCL 2(сил)
2+ - 2+ - 2+ -
Ba/+2OH+Cu+2CL/=Cu(OH)2+ Ba/+2CL/
2+ -
Cu+2OH=Cu(OH)2
Ca+4OCL2-1 + 2HCL-1 = Ca+2CL2 + CL20 + H2O
Ca+4 + 2e = Ca+2 – окислитель
2CL-1 – 2e = CL02 – восстановитель