Mg+2HCl=MgCl2+H2
n(Mg)=20/24=0,83 моль
===> n(MgCl2)=0,83 моль
m(MgCl2)=0.83*95=79,2г
Отв: 79,2г
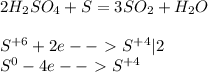
1)Уравнение реакции в общем виде: 4Ме + 3О2 = 2Ме2О3 Отношение количества вещества (Ме) к количеству вещества (Ме2О3) по уравнению реакции =4:2 или 2:1,следовательно (ню) Ме в 2 раза больше, чем Ме2О3. 2)Обозначим М (молярную массу Ме) через Х, тогда М (молярная масса оксида Ме2О3) будет равна 2Х +48 3)количество вещества Ме= м (масса 3г) / м (молярн. масса Х) = 3 / Х г/моль (а) количество вещества оксида = м (5,67г ) / М (2Х +48) =5,67 / 2х+48 г/моль (б) 4)Тогда, т. к. количество вещества Ме в 2 раза больше, следовательно, если значение (а) разделим на (б) = 2 3 / Х : (деление) 5,67 / 2Х +48 =2 3(2Х +48) :( 2Х ) х 5,67=2 6Х +144=11,34Х Х=27(г/моль) т. к. (Х) -молярная масса неизвестного металла, следовательно, это металл Аl(алюминий, степень окисления в оксиде у алюминия (+3),М =27 г моль.
Дано:
m (Mg) = 20 г
HCl
Найти:
m (MgCl2)
20 г x г
Mg + 2HCl = MgCl2 + H2↑
24 г 95 г
20 г --- х г
24 г --- 95 г
х = 20 г ∙ 95 г\24 г = 79,2 г
ответ: m (MgCl2) = 79,2 г