Объяснение:
Высший оксид вида
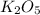
характерен для элементов
V группы а-подгруппы (N, P, As, Sb, Bi)
в таблице Менделеева
Для этих же элементов характерен гидрид вида:
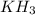
Известно, что в соединении с гидрогеном (водород, Н) массовая доля гидрогена составляет 8.8%.
Напишем уравнение
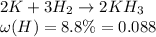
Молекулярная масса КН3 равна:
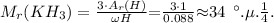
Следовательно, атомная масса элемента К равна:

И действительно в V группе а-подгруппе есть элемент с атомной массой 31 а.е.м.
И этот элемент - фосфор (Р)
Это 15 элемент в Таблице. Его электронная формула имеет вид:
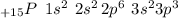
Гидрат оксида фосфора, который соответствует его высшему оксиду (гидроксид фосфора) - это фосфорная кислота, чаще всего имеется в виду ортофосфорная кислота
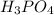
однако может встречаться и метафосфорная кислота
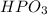
Фосфорная кислота реагирует с
с основными оксидами:
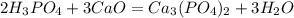
с основаниями:
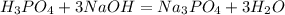
Характерная реакция на фосфат-ионы - взаимодействие с нитратом серебраAgNO3. При этом образуется ярко-желтый осадок фосфата серебра:

288 г х л
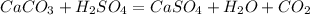
100 г 22,4 л
1. Найдем чистую массу карбоната кальция в мраморе,учитывая,что его содержится 90%(100-10=90):
m(CaCO3)=m(мрамора)*w(CaCO3)=320*0,9=288 г
2. Подставив эту массу в уравнение реакции получим объем углекислого газа:
при взаимодействии 100 карбоната выделяется 22,4 л углекислого газа, а
при -- // -- 288 г__________________х л, откуда
х=288*22,4/100=приблизительно 65 л
Объяснение:
вот и зделай мой ответь лучшим