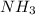 , сближающая его с щелочами, является хорошая "принимать" атомы водорода.
, сближающая его с щелочами, является хорошая "принимать" атомы водорода.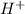 (а точнее
(а точнее 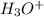 - катион водорода чрезвычайно активен и "липнет" к чему угодно, что может его взять) резко падает. Аммиак "перетягивает одеяло" даже у нейтральной воды (тем самым образуя смесь
- катион водорода чрезвычайно активен и "липнет" к чему угодно, что может его взять) резко падает. Аммиак "перетягивает одеяло" даже у нейтральной воды (тем самым образуя смесь 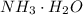 , которая в общем-то может образовать ионы
, которая в общем-то может образовать ионы 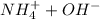 , хотя говорить о гидроксиде аммония не принято - потому что эта "соль" существовать только в растворах).
, хотя говорить о гидроксиде аммония не принято - потому что эта "соль" существовать только в растворах).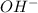 (к слову - растворимость у всех реально существующих солей аммония очень похожа на растворимости солей щелочных металлов, что также указывает на некое сходство), оба этих раствора выступать как акцепторы (т.е. "принимающие", "отнимающие") водород.
(к слову - растворимость у всех реально существующих солей аммония очень похожа на растворимости солей щелочных металлов, что также указывает на некое сходство), оба этих раствора выступать как акцепторы (т.е. "принимающие", "отнимающие") водород.
ответ:H2CO3 – угольная кислота, HCO3
–
– гидрокарбонат, CO3
2– – карбонат
Н2SiО3 – (мета)кремниевая кислота, SiO3
2– – силикат
HNO3 – азотная кислота, NO3
–
– нитрат
HNO2 – азотистая кислота, NO2
–
– нитрит
H3PO4 – (орто)фосфорная кислота, H2PO4
–
– дигидрофосфат, HPO4
2– – гидрофосфат, PO4
3– – фосфат
H2SO4 – серная кислота, HSO4
–
– гидросульфат, SO4
2– – сульфат
H2SO3 – сернистая кислота, HSO3
–
– гидросульфит, SO3
2– – сульфит
H2S – сероводородная кислота, HS–
– гидросульфид, S2– – сульфид
HF – фтороводородная (плавиковая) кислота, F–
– фторид
HCl – хлороводородная (соляная) кислота, Cl–
– хлорид
HBr – бромоводородная кислота, Br–
– бромид
HI – иодоводородная кислота, I
–
– иодид
HMnO4 – марганцевая кислота, MnO4
–
– перманганат
H2CrO4 – хромовая кислота, CrO4
2– – хромат
H2Cr2O7 – дихромовая кислота, Cr2O7
2– – ди(би)хромат
HClO – хлорноватистая кислота, ClO–
– гипохлорит
HClO2 – хлористая кислота, ClO2
–
– хлорит
HClO3 – хлорноватая кислота, ClO3
–
– хлорат
HClO4 – хлорная кислота, ClO4
–
– перхлорат
HCN – синильная кислота, CN–
– цианид
Объяснение:
гы