1)2C2H6O+7O2=4CO2+6H2O
------------------------------------------------------------------------------------------------------
2) в 32 г кислорода содержится 6,02 ×10 ²³ составляем пропорцию:
32 - 6,02 ×10 ²³
480- х= 90,3×10 ²³
х= 6,02 ×10 ²³×480/32=90,3 ×10 ²³= 9,03×10²⁴
ответ:9,03×10²⁴
------------------------------------------------------------------------------------------------------
3)Пишем реакцию
10г х=?
4P +5 O₂= 2P₂O₅
124г 284г
х=284×10/124=22,9г
ответ:22,9г
------------------------------------------------------------------------------------------------------
4)пишем реакцию
10г х=?
4P + 5 O2 =2 P2O5
124г 160г
х=160×10/124=12,9г
ответ:12,9г
------------------------------------------------------------------------------------------------------
5)реакция: 4Al+3O2=2 Al2O3
рассчитываем массы веществ: Mr(4Al)=108г; Mr(2 Al2O3)=204г
делим массу оксида на массу металла:204/108=1,(8)
ответ: в 1,8 раз
------------------------------------------------------------------------------------------------------
6)реакция:
5г 50г х=?
2H2+ O2= 2H2O
4г 32г 36г
х= 36×5/4=45г
ответ:45 г
------------------------------------------------------------------------------------------------------
7)решение на фото
Объяснение:
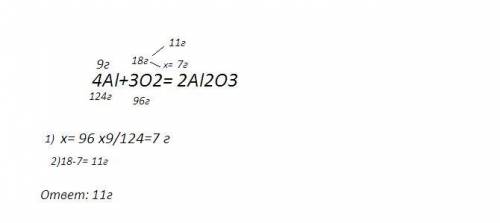
ответ: 14,35 г
Вычислите массу осадка, который образуется при действии избытка раствора хлорида калия на 340г 5% раствора нитрата серебра.
Дано:
m(AgNO₃) = 340 г
ω(AgNO₃) = 5% или 0,05
Найти:
m(AgCl)-?
m(AgNO₃) = m(AgNO₃)×ω(AgNO₃)
m(AgNO₃) = 340 г*0,05 = 17 г
М(AgNO₃) = 170 г/моль
n(AgNO₃) = m(AgNO₃)/M(AgNO₃)
n(AgNO₃) = 17 г/170 г/моль = 0,1 моль
М(AgNO₃) = 143,5 г/моль
KCl + AgNO₃ = AgCl + KNO₃
Из УХР видно, что n(AgCl)=n(AgNO₃)
n(AgCl) = 0,1 моль
m(AgCl) = n(AgCl)*M(AgCl)
m(AgCl) = 0,1 моль*143,5 г/моль = 14,35 г
ответ: 14,35 г