Теллуровая кислота — слабая многоосновная неорганическая кислота состава H6TeO6 (H2TeO4•2H2O), соответствующая высшей степени окисления теллура (+6)
Физические свойства
Бесцветные кристаллы, растворимые в воде, не растворяются в концентрированной азотной кислоте.
Получают взаимодействием элементарного теллура с 30%-м раствором перекиси водорода при нагревании на водяной бане. При температуре ниже 10 °С выделяется из раствора в виде кристаллогидрата H6TeO6•4H2O. Соли теллуровой кислоты могут быть получены растворением оксида теллура(VI) в концентрированных растворах щелочей либо сплавлением теллуритов с КNО3
Химические свойства
Слабая кислота; К1 = 2•10−8, К2 = 1•10−11. Относительно неустойчива; при нагревании до 140 °С образует аллотеллуровую кислоту — вязкую хорошо смешивающуюся с водой жидкость, представляющую собой, по-видимому, раствор смеси полимерных теллуровых кислот. Выше 300 °С распадается на TeO3 и воду.
Соли теллуровой кислоты — теллураты. На металл могут замещаться все атомы водорода, поэтому известны как частично (Na2H4TeO6), так и полностью замещённые (Na6TeO6) производные. Na6TeO6, получаемый сплавлением теллуровой кислоты с NaOH, на воздухе постепенно переходит в Na2H4TeO6•3H2O.
Молярная масса: 229,64 г/моль
№1. Дано:
m(Mg)=48 г
______________________
m(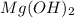 )=?
)=?
2 моль x
1 моль 1 моль
n(Mg)=m/M=48г/24г/моль=2 моль
m(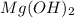 )=n*M=2 моль* 42г/моль=84 г
)=n*M=2 моль* 42г/моль=84 г
ответ: 84 г
С твоим ответом не сошлось, т.к. у тебя реакция неправильная.
№2. а, в, г, ж
№3. Дано:
m(HCl)=73 г
__________________________
m(NaCl)=?
0,09 моль х
2 моль 1 моль
m(HCl)=73г*4,5%/100%=3,285 г
n(HCl)=3,285г/36,5г/моль=0,09 моль
x=n(NaCl)=0,045 моль
m(NaCl)=0.045 моль*58,5г/моль=2,6325 г
ответ: 2,6325 г