1 задание.
1. ЗАпишем уравнение реакции: 3Al+2H2SO4 = Al3(SO4)2+2H2
Рассчитаем количества вещества:
n(Al)=5.4/27=0.2моль
m(H2SO4)=80*0.2=16гр, n(H2SO4)=16/98=0,1632моль
Серная кислота в недостатке, по ней и считаем.
n(H2)=n(H2SO4)=0,1632 моль.
V(H2)=0.1632*22.4=3.657л
m(H2)=0.1632*2=0.3264гр.
2 задание.
1. ЗАпишем уравнение реакции: Zn+2HCl = ZnCl2+H2
2. Рассчитаем количество вещества:
n(Zn)=26/65=0.4моль
m(HCl)=300*0.073=21.9гр
n(HCl)=21.9/36.5=0.6моль
Цинк в недостатке, по нему и считаем
n(Zn)=n(H2)=0.4моль
V(H2)=0,4*22,4=8,96моль
m(H2)=0.4*2=0.8гр
5,4 г 7,3 г,х г у л
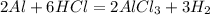
54 г 219 г 67,2 л
1. Сначала найдем чистую массу кислоты в растворе:
m(HCl)=m(раствора)*w(HCl)=73*0,1=7,3 г
2. Теперь определим,какое из исходных веществ прореагирует полностью, приняв массу,например,кислоты за Х:
для полного взаимодействия 54 г алюминия потребуется 219 г кислоты, а
для -- // -- 5,4 г____________________х г, откуда
х=5,4*219/54=21,9 г
3. Но так как по условиям дано всего 7,3 г,значит алюминий останется в избытке,поэтому расчет объема водорода ведем по массе кислоты:
при взаимодействии 219 г кислоты выделяется 67,2 л водорода, а
при -- // -- 7,3 г___________________у л, откуда
у=7,3*67,2/219=2,24 л
Объяснение:
Атомная масса цинка = 65.4
40 / 65,4 = 0,611621 моль цинка.
В 100гр 60%соляной кислоты содержится 60гр хлороводорода.
HCl имеет атомный вес 1+35,4 =36,4
60 / 36,4 =1,65 моль
На каждый атом цинка нужно две молекулы хлороводорода.
Понадобится минимум 0,611621 *2 = 1,223242 < 1,65
Значит, хлороводорода в соляной кислоте хватит для реакции, и даже с небольшим избытком.
Реакция: Zn + 2HCl = ZnCl2 +H2
На каждый 1 моль реагирующего цинка выделяется (по условиям задачи) 0,95 моль водорода (молекулярного, не атомного!)
0,611621 * 0,95 = 0,58104 моль водорода (молекулярного) = 1,16208 грамм.
Плотность водорода равна 0,0898 кг/м3 = 0,0898 гр/литр.
Объём = масса/плотность = 1,16208 / 0,0898 = 12,94 литра.