8 г, х г 9,8 г у г
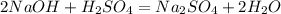
80 г 98 г 142 г
1.Сначала определим чистые массы кислоты и щелочи в растворах:
m(H2SO4)=m1(раствора)*w(H2SO4)=200*0,049=9,8 г
m(NaOH)=m2(раствора)*w(NaOH)=200*0,04=8 г
2. Теперь узнаем,какое из исходных веществ прореагирует полностью(без остатка),приняв одно из них за Х,например,массу щелочи:
для полной нейтрализации 80 г гидроксида необходимо 98 г кислоты, а
для --//--//-- х г______________________9,8 г, откуда
х=80*9,8/98=8 г
3.Как видим,все исходные вещества прореагируют полностью,значит расчет массы соли ведем по массе одного из них,например по массе щелочи:
при взаимодействии 80 г гидроксида образуется 142 г соли, а
при --//--//-- 8 г____________________у г, откуда
у=8*142/80=14,2 г
1)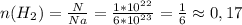 моль
моль
ответ: 0,34г
2) формула: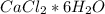
ответ: 64%
3)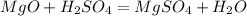
1. Через массы вычисляем количество моль и узнаём, какое из них в избытке и какое в недостатке. Через недостаток можно будет найти массу соли, а избыток просто отбрасываем:
Значит, решаем через оксид магния.
2. Зная коэффициенты в уравнении, можно составить соотношение и узнать количество моль соли:
3. Зная количество моль соли, можно найти её массу:
ответ: 30г
4) Во вложении смотри.
5) вариант 4 -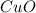
6) вариант 3 -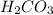 , т.к многоосновная кислота.
, т.к многоосновная кислота.