а) Si → SiO2 → Na2SiO3 → H2SiO3;
Si + O2 = SiO2
SiO2 + 2NaOH = Na2SiO3 + H2O
Na2SiO3 + HCl = 2NaCl + H2SiO3↓
б) Mg → MgO → MgSO4 → Mg3(PO4)2;
2Mg + O2 = 2MgO
MgO + H2SO4 =MgSO4 + H2O
3MgSO4 + 2Na3PO4 = 3Na2SO4 + Mg3(PO4)2↓
в) СН4 → СО2 → Na2СO3 → ВаСО3;
CH4 + 2O2 = CO2↑ + 2H2O
CO2 + Na2O = Na2CO3
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
г) СН3СООH → (СН3СОО)2Cu → (СН3СОО)2Ва;
2СН3СООH + CuO = (СН3СОО)2Cu + H2O
(СН3СОО)2Cu + Ba(OH)2 = (СН3СОО)2Ва + Cu(OH)2↓
ґ) Pb(OH)2 → PbO → Pb(NO3)2 → PbS;
Pb(OH)2↓ = PbO + H2O
PbO + 2HNO3 = Pb(NO3)2 + H2O
Pb(NO3)2 + Na2S = PbS↓ + 2NaNO3
д) CrCl3 → Cr(OH)3 → K3[Cr(OH)6] → Cr2(SO4)3.
CrCl3 + 3NaOH = Cr(OH)3↓ + 3NaCl
Cr(OH)3 + 3KOH = K3[Cr(OH)6]
2K3[Cr(OH)6] + 6H2SO4 = 3K2SO4 + Cr2(SO4)3 + 12H2O
Объяснение:
5,4 г 7,3 г,х г у л
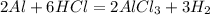
54 г 219 г 67,2 л
1. Сначала найдем чистую массу кислоты в растворе:
m(HCl)=m(раствора)*w(HCl)=73*0,1=7,3 г
2. Теперь определим,какое из исходных веществ прореагирует полностью, приняв массу,например,кислоты за Х:
для полного взаимодействия 54 г алюминия потребуется 219 г кислоты, а
для -- // -- 5,4 г____________________х г, откуда
х=5,4*219/54=21,9 г
3. Но так как по условиям дано всего 7,3 г,значит алюминий останется в избытке,поэтому расчет объема водорода ведем по массе кислоты:
при взаимодействии 219 г кислоты выделяется 67,2 л водорода, а
при -- // -- 7,3 г___________________у л, откуда
у=7,3*67,2/219=2,24 л
Есть
Объяснение:
С целым мелом расстворение идёт постепенно (слоями) а с парашком реакция будет мгновенной ведь больше соприкосновения реактивав